
 在如图所示的装置中,若通入直流电5min时,铜电极质量增加2.16g,试回答:
在如图所示的装置中,若通入直流电5min时,铜电极质量增加2.16g,试回答:| 2.16g |
| 108g/mol |
| 1 |
| 4 |
| 0.005mol |
| 0.1L |
| 0.02mol |
| 0.2L |


科目:高中化学 来源: 题型:
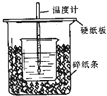 用50mL 0.50mol/L盐酸与50mL 0.55mol/LNaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
用50mL 0.50mol/L盐酸与50mL 0.55mol/LNaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
 用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
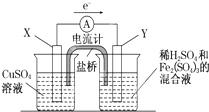 金属铜不溶于稀硫酸,可溶于铁盐溶液生成铜盐与亚铁盐.现将一定量的铜片加入到100mL稀硫酸和硫酸铁的混合溶液中,铜片完全溶解(不考虑盐的水解及溶液体积的变化).
金属铜不溶于稀硫酸,可溶于铁盐溶液生成铜盐与亚铁盐.现将一定量的铜片加入到100mL稀硫酸和硫酸铁的混合溶液中,铜片完全溶解(不考虑盐的水解及溶液体积的变化).2- 4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
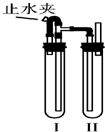 在如图所示的装置中,用NaOH溶液、铁屑、稀H2SO4制备Fe(OH)2白色沉淀.
在如图所示的装置中,用NaOH溶液、铁屑、稀H2SO4制备Fe(OH)2白色沉淀.查看答案和解析>>
科目:高中化学 来源: 题型:
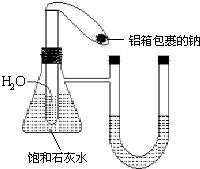 在如图所示的装置中,锥形瓶中装有饱和石灰水,小试管中装有一定量的水,气球中有一小块用铝箔包着的钠,整套装置气密性良好,未反应前U形管两端液面相平.现将气球中的金属钠放入小试管中与水反应.
在如图所示的装置中,锥形瓶中装有饱和石灰水,小试管中装有一定量的水,气球中有一小块用铝箔包着的钠,整套装置气密性良好,未反应前U形管两端液面相平.现将气球中的金属钠放入小试管中与水反应.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com