
| A. | 12g石墨中含有C-C键的个数为1.5NA | |
| B. | 60g SiO2中含有Si-O键的个数为2NA | |
| C. | 18g冰中最多含有4 NA个氢键 | |
| D. | 标准状况下,11.2 L CHCl3中含有的分子数为0.5NA |
分析 A.石墨中每个C原子与其它3个C原子成键,则平均每个C原子成键数目为3×$\frac{1}{2}$=1.5个;
B.Si02中每个Si原子与4个O原子成键;
C.1个水分子中氧原子与两个氢原子生成两个氢键、氢原子与氧原子形成1个氢键,采用均摊法计算出1mol水中含有的氢键;
D.标准状况下三氯甲烷不是气体.
解答 解:A.石墨中每个C原子与其它3个C原子成键,则平均每个C原子成键数目为3×$\frac{1}{2}$=1.5个,则12g石墨含C原子的物质的量为1mol,则C-C键的个数为1.5NA,故A正确;
B.Si02中每个Si原子与4个O原子成键,60g Si02的物质的量为1mol,含Si-O键的个数为4NA,故B错误;
C.18g水的物质的量为:$\frac{18g}{18g/mol}$=1mol,根据均摊法,1mol氢原子形成$\frac{1}{2}$mol氢键,1mol氧原子形成$\frac{1}{2}$×2=1mol氢键,1mol水中含有2mol氢原子、1molO,能够形成2mol氢键,所以1mol水中含有的氢键数目为2NA,故C错误;
D.标准状况下,11.2 L CHCl3中物质的量不是0.5mol,故D错误;
故选A.
点评 本题考查阿伏加德罗常数的有关计算和判断、微粒结构、气体摩尔体积条件应用,题目难度中等,注意掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,明确均摊法在化学计算中的应用,试题有利于培养学生的逻辑推理能力,提高学生的灵活运用能力.


科目:高中化学 来源: 题型:选择题
| A. | 仅⑤ | B. | 仅②④ | C. | 仅②⑤ | D. | 仅③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
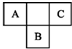 A、B、C为短周期元素,在周期表中所处的位置如图所示.A、C两元素的原子核外电子数之和等于B原子的质子数.B原子核内质子数和中子数相等.
A、B、C为短周期元素,在周期表中所处的位置如图所示.A、C两元素的原子核外电子数之和等于B原子的质子数.B原子核内质子数和中子数相等. ,C的氢化物与B的氢化物的稳定性强弱顺序为HF>H2S(填化学式).
,C的氢化物与B的氢化物的稳定性强弱顺序为HF>H2S(填化学式).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③⑤⑦ | B. | ①②③⑦ | C. | ①⑦ | D. | ②④⑥⑧ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1个 | B. | 2 | C. | 3 | D. | 4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
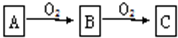
 2SO3.
2SO3.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com