
【题目】已知: ①25℃时弱电解质电离平衡数;Ka(CH3COOH)═1.8×10﹣5 , Ka(HSCN)═0.13;
难溶电解质的溶度积常数:KSD(CaF2)═1.5×10﹣10
②25℃时,2×10﹣3molL﹣1氢氟酸水溶液中,调节溶液pH(忽略体积变化),得到c (HF)、C(F﹣)与溶液pH的变化关系,如图1所示:
请根据以下信息回答下列问题:
(1)25℃时,将20mL 0.10molL﹣1CH3COOH溶液和20mL 0.1 molL﹣1 HSCN溶液分别 与20mL 0.10molL﹣1NaHCO3 溶液混合,实验测得产生的气体体积(V)随时间(t)变化的示意图为图2所示: 反应初始阶段,两种溶液产生CO2气体的速率存在明显差异的原因是 ,
反应结束后所得两溶液中,C(CH3COO﹣)c(SCN﹣)(填“>”、“<”或“=”)
(2)25℃时,HF电离平衡常数的数值Ka≈ .
(3)4×10﹣3molL﹣1HF溶液与4×10﹣4molL﹣1CaCl2溶液等体积混合,调节混合液pH为4.0(忽略调节混合液体积的变化),通过列式计算说明是否有沉淀产生.
【答案】
(1)相同的起始条件,两种酸的电离程度不同导致溶液中起始反应时氢离子浓度不同引起反应速率不同;<
(2)4×10﹣4
(3)有沉淀产生
【解析】解:(1)①反应速率与氢离子浓度成正比,硫氰酸的电离平衡常数大于醋酸,则硫氰酸的电离程度大于醋酸,等浓度的两种溶液中,硫氰酸中氢离子浓度大于醋酸,所以醋酸的反应速率小于硫氰酸;
酸的电离平衡常数越大,酸的电离程度越大则酸的酸性越强,其酸根水解能力越小,硫氰酸的电离平衡常数大于醋酸,所以醋酸根离子的水解能力大于硫氰酸根离子,则c(CH3COO﹣)<c(SCN﹣),
所以答案是:相同的起始条件,两种酸的电离程度不同导致溶液中起始反应时氢离子浓度不同引起反应速率不同;<;(2)根据图象知,当pH=4时,c(H+)=10﹣4 mol/L,c(F﹣)=1.6×10﹣3 mol/L,c(HF)=4×10﹣4 mol/L,电离平衡常数Ka= ![]() =
= ![]() =4×10﹣4,
=4×10﹣4,
所以答案是:4×10﹣4;(3)由图可知当pH=4.0时,溶液中的c(F﹣)=1.6×10﹣3molL﹣1,因等体积混合则溶液中c(Ca2+)=2.0×10﹣4molL﹣1,即c(Ca2+)×c2(F﹣)=5.1×10﹣10>Ksp(CaF2))=1.5×10﹣10,所以有沉淀产生,所以答案是:有沉淀产生.
【考点精析】关于本题考查的化学平衡的计算,需要了解反应物转化率=转化浓度÷起始浓度×100%=转化物质的量÷起始物质的量×100%;产品的产率=实际生成产物的物质的量÷理论上可得到产物的物质的量×100%才能得出正确答案.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】下列物质的分类正确的是( )
酸 | 碱 | 盐 | 氧化物 | |
A | H2SO4 | Na2CO3 | NaCl | SO2 |
B | CO2 | NaOH | NaCl | Na2CO3 |
C | HCl | NaOH | CaF2 | CH3COOH |
D | HNO3 | KOH | CaCO3 | CaO |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学实验小组的同学为探究和比较SO2和氯水的漂白性,设计了如下的实验装置。
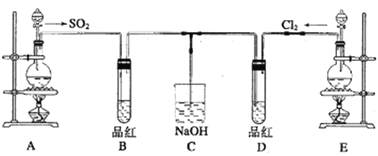
(1)实验室用装置A制备SO2,某同学在实验时发现打开A的分液漏斗活塞后,漏斗中液体未流下,该同学怎样操作可以使分液漏斗液体顺利滴下___________________________;
(2)实验室用装置E制备Cl2,其反应的化学方程式为____________________,若实验室用酸性KMnO4和浓盐酸反应制Cl2,反应的离子方程式为________________________。
(3)反应开始一段时间后,观察到B、D两个试管中的品红溶液都褪色,停止通气后,再给B、D两个试管分别加热;两个试管中的现象分别为:
B:_______________________,D:_________________________。
(4)若将B中品红换成Na2S溶液,通SO2一段时间后B中现象为_____________________。
(5)另一个实验小组的同学认为SO2和氯水都有漂白性,二者混合后的漂白性肯定会更强。他们将制得的SO2和Cl2按1:1同时通入到品红溶液中,结果发现褪色效果并不像想象的那样。请你分析该现象的原因(用化学方程式表示)_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述错误的是( )
A.通常情况下,甲烷跟强酸、强碱、强氧化剂都不反应
B.甲烷化学性质比较稳定,不能被任何氧化剂氧化
C.甲烷跟氯气反应无论生成CH3Cl、CH2Cl2、CHCl3还是CCl4 , 都属于取代反应
D.甲烷的四种取代物都难溶于水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】晶体硅是信息科学和能源料学的一种重要材料,可用作制芯片和太阳能电池等。下列流程图是工业上制取纯硅的一种方法:
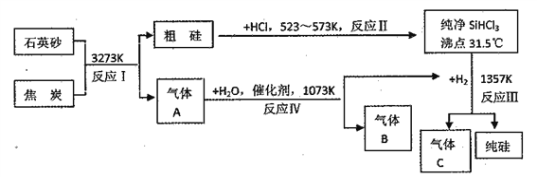
请回答下列问题
(1)反应I的化学方程式为______________________;在上述生产过程中除反应I属于置换反应的有________________________(填反应的代号“I→IV")。
(2)A、B、C三种气体,在“节能减排”中作减排目标的一种气体是________。(写化学式)
(3)纯硅可与强碱反应放出氢气,其化学方程式为_______________________________。
(4)工业上合成氨的原料H2是先将焦炭与水蒸气反应生成水煤气,再提纯水煤气得到纯净的H2,则工业上制得纯净H2的化学方程式为_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于XOH型化合物而言,X是除H、O以外的其他元素时,下列说法中正确的是( )
A.XOH的水溶液不能导电B.当X是金属性很强的元素时,XOH一定是强碱
C.XOH一定是离子化合物D.XOH一定是共价化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关2个电化学装置的叙述正确的是( ) 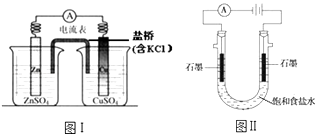
A.图Ⅰ,电流形成的完整过程是:负极Zn﹣2e﹣═Zn2+ , 电子经导线流向正极,正极Cu2++2e﹣═Cu
B.图Ⅰ,在不改变总反应的前提下,可用Na2SO4替换ZnSO4 , 用石墨替换Cu棒
C.图Ⅱ,通电后H+和Na+先从阳极区移动到阴极,然后阴极才发生反应2H++2e﹣═H2↑
D.图Ⅱ,通电后,由于OH﹣向阳极迁移,导致阳极附近pH升高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海洋植物如海带、海藻中含有丰富的碘元素,碘元素以碘离子的形式存在,实验室里从海藻中提取碘的流程图如下: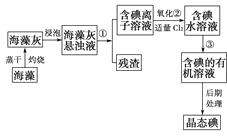
(1)指出提取碘的过程中有关的实验操作名称:
① , ③。
写出过程②中有关反应的离子方程式:。
(2)提取碘的过程中,可供选择的有机溶剂是( )(填序号)。
A.甲苯、酒精
B.四氯化碳、苯
C.汽油、乙酸
D.汽油、甘油
(3)为使海藻灰中碘离子转化为碘的有机溶液,实验室里有烧杯、玻璃棒、集气瓶、酒精灯、导管、圆底烧瓶、石棉网以及必要的夹持仪器、物品,尚缺少的玻璃仪器是。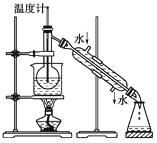
(4)从含碘的有机溶液中提取碘和回收有机溶剂,还需经过蒸馏,指出上图所示实验装置中的错误之处:
①;
②;
③。
(5)进行上述蒸馏操作时,使用水浴的原因是 , 最后晶体碘在里聚集。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列溶液含有的氯离子物质的量浓度最大的是( )
A.2mL0.2mol/LNaCl溶液B.1mL0.2mol/LKCl溶液
C.1mL0.2mol/LCaCl2溶液D.1mL0.1mol/LAlCl3溶液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com