
南海某小岛上,解放军战士为了寻找合适的饮用水源,对岛上山泉水进行分析化验,结果显示水的硬度为28°(属于硬水),主要含钙离子、镁离子、氯离子和硫酸根离子。请思考下列问题:
(1)该泉水属于 硬水(填写“暂时”或“永久”)。
(2)若要除去Ca2+、Mg2+可以往水中加入石灰和纯碱,试剂添加时先加 后加 ,原因是 。
(3)目前常用阳离子交换树脂如NaR、HR来进行水的软化,若使用HR作为阳离子交换树脂则水中的Ca2+、Mg2+与交换树脂的 起离子交换作用。若使用NaR作为阳离子交换树脂失效后可放入5%-8% 溶液中再生。
(4)岛上还可以用海水淡化来获得淡水。下面是海水利用电渗析法获得淡水的原理图,已知海水中含Na+、Cl-、Ca2+、Mg2+、SO42—等离子,电极为惰性电极。请分析下列问题:
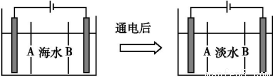
①阳离子交换膜是指 (填A或B)。
②写出通电后阳极区的电极反应式: ;阴极区的现象是: 。
(1)永久
(2)石灰 纯碱 过量的钙离子可通过纯碱使之沉淀下来
(3)H+ NaCl
(4)①B ②2Cl-+2e- Cl2↑ 电极上产生无色气体,溶液中出现少量白色沉淀。
Cl2↑ 电极上产生无色气体,溶液中出现少量白色沉淀。
考点二 化学与工农业生产
【解析】(1)由较多钙离子和镁离子以及硫酸根离子引起的硬度,叫永久硬度。
(2)纯碱除了除去原溶液中的Ca2+还要除去加入的Ca2+,因此一定把纯碱放在石灰的后面加入。
(3)再利用阳离子交换原理,将失效后的NaR放入NaCl的溶液中,使其获得再生。
(4)通电后,阳离子Na+向着阴极移动,故B为阳离子交换膜,电解时,阴离子Cl-在阳极得电子生成Cl2,阴极区H+得电子,生成H2同时产生OH-,与Mg2+和Ca2+反应生成氢氧化镁和氢氧化钙沉淀。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2014高考化学名师选择题专练 元素周期表元素周期律练习卷(解析版) 题型:选择题
X、Y、Z三种短周期元素,原子半径的大小关系为:r(Y)>r(X)>r(Z),原子序数之和为16。X、Y、Z三种元素的常见单质在适当条件下可发生如图所示变化,其中B和C均为常见的10电子分子。下列说法不正确的是( )
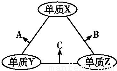
A.X元素位于ⅥA族
B.A不能溶解于B中
C.A和C不可能发生氧化还原反应
D.B的沸点高于C的沸点
查看答案和解析>>
科目:高中化学 来源:2014高考化学名师综合题专练 化学实验练习卷(解析版) 题型:实验题
为探究某铁碳合金与浓硫酸在加热条件下的反应的部分产物并测定铁碳合金中铁元素的质量分数,某化学活动小组设计了如图所示的实验装置,并完成以下实验探究。
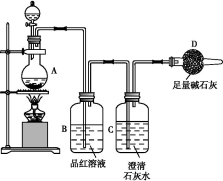
(1)往圆底烧瓶中加入m g铁碳合金,并滴入过量浓硫酸,未点燃酒精灯前,A、B均无明显现象,其原因是:①常温下,Fe在浓硫酸中钝化;② 。
(2)反应一段时间后,从A中逸出气体的速率仍然较快,除因反应温度较高外,还可能的原因是 。
(3)装置B的作用是 。
(4)甲同学观察到装置C中有白色沉淀生成,他得出了使澄清石灰水变浑浊的气体是二氧化碳。装置A中能产生二氧化碳的化学方程式为 。
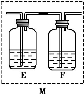
(5)乙同学认为甲同学的结论是错误的,他认为为了确认二氧化碳的存在,需在装置B-C之间添加装置M。装置E、F中盛放的试剂分别是 、 。重新实验后观察到装置F中的现象是 。
(6)有些同学认为合金中铁元素的质量分数可用KMnO4溶液来测定(5Fe2++Mn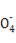 +8H+
+8H+ 5Fe3++Mn2++4H2O)。
5Fe3++Mn2++4H2O)。
测定铁元素质量分数的实验步骤如下:
Ⅰ.往烧瓶A中加入过量的还原剂使溶液中的Fe3+完全转化为Fe2+,过滤,得到滤液B;
Ⅱ.将滤液B稀释为250 mL;
Ⅲ.取稀释液25.00 mL,用浓度为c mol·L-1的酸性KMnO4溶液滴定,三次滴定实验所需KMnO4溶液体积的平均值为V mL。
①步骤Ⅱ中,将滤液B稀释为250 mL需要用到的玻璃仪器除烧杯、玻璃棒、胶头滴管外,还必须要用到的是 。
②丙同学设计了下列滴定方式(夹持仪器省略),最合理的是 (填字母序号)。
③滴定过程中 (填“需要”或“不需要”)加入指示剂。
④铁碳合金中铁元素的质量分数为 。
查看答案和解析>>
科目:高中化学 来源:2014高考化学名师知识点精编 选修3物质结构与性质练习卷(解析版) 题型:填空题
A、B、C、D、E是周期表中前四周期的元素,其有关性质或结构信息如下表:
元素有关性质或结构信息
A负二价的A元素的氢化物在通常状况下是一种液体,其中A的质量分数为88.9%
BB原子得到一个电子后3p轨道全充满
CC原子的p轨道半充满,它的气态氢化物能与其最高价氧化物的水化物反应生成一种常见的盐X
DD元素的最高化合价与最低化合价的代数和为零,其最高价氧化物为分子晶体
EE元素的核电荷数等于A元素和B元素氢化物的核电荷数之和
(1)元素Y是C下一周期同主族元素,比较B、Y元素的第一电离能I1(B) I1(Y)。
(2)E元素原子的核外电子排布式为
(3)盐X的水溶液呈 (填“酸性”、“碱性”或“中性”),B元素最高价含氧酸一定比D元素最高价含氧酸的酸性 (填“强”或“弱”)。
(4)C单质分子中σ键和π键的个数比为 ,C的氢化物在同族元素的氢化物中沸点出现反常,其原因是
(5)用高能射线照射液态H2A时,一个H2A分子能释放出一个电子,同时产生一种具有较强氧化性的阳离子,试写出该阳离子的电子式: ,
写出该阳离子与硫的氢化物的水溶液反应的离子方程式:
查看答案和解析>>
科目:高中化学 来源:2014高考化学名师知识点精编 选修2化学与技术练习卷(解析版) 题型:填空题
锆产业是极有发展潜力及前景的新兴产业,锆(Zr)元素是核反应堆燃料棒的包裹材料,二氧化锆(ZrO2)可以制造耐高温纳米陶瓷。我国有丰富的锆英石(ZrSiO4),含Al2O3、SiO2、Fe2O3等杂质,生产锆流程之一如下:
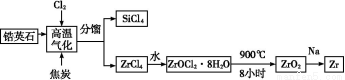
试回答下列问题:
(1)写出上述流程中高温气化的反应方程式(碳转化成CO): ;
(2)写出ZrOCl2·8H2O在900 ℃生成ZrO2的反应方程式 ;
(3)关于二氧化锆纳米陶瓷和锆合金的说法不正确的是 (单选)。
A.二氧化锆纳米陶瓷是新型无机非金属材料
B.1纳米=10-10米
C.锆合金的硬度比纯锆要高
D.日本福岛核电站的爆炸可能是由锆合金在高温下与水蒸气反应产生的氢气爆炸引起
查看答案和解析>>
科目:高中化学 来源:2014高考化学名师知识点精编 专题9溶液中的电离平衡练习卷(解析版) 题型:选择题
电导率可用于衡量电解质溶液导电能力大小。室温下,用0.100 mol·L-1 NH3·H2O溶液滴定10.00 mL浓度均为0.100 mol·L-1盐酸和CH3COOH溶液的混合溶液,所得曲线如图所示。下列说法正确的是( )
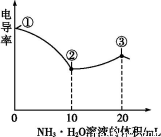
A.①点溶液中c(H+)为0.200 mol·L-1
B.溶液温度高低为①>③>②
C.③点溶液中有c(Cl-)>c(CH3COO-)
D.③点后因离子数目减少使溶液电导率略降低
查看答案和解析>>
科目:高中化学 来源:2014高考化学名师知识点精编 专题9溶液中的电离平衡练习卷(解析版) 题型:选择题
将0.1 mol·L-1的氨水加水稀释至0.01 mol·L-1,稀释过程中温度不变,下列叙述正确的是( )
A.稀释后溶液中c(H+)和c(OH-)均减小
B.稀释后溶液中c(OH-)变为稀释前的1/10
C.稀释过程中氨水的电离平衡向左移动
D.稀释过程中溶液中 增大
增大
查看答案和解析>>
科目:高中化学 来源:2014高考化学名师知识点精编 专题7元素周期表与元素周期律练习卷(解析版) 题型:选择题
X、Y、Z是三种短周期的主族元素,在周期表的位置如图,X原子的最外层电子数是其次外层电子数的3倍,下列说法正确的是( )
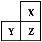
A.原子半径:Y>Z>X
B.气态氢化物的热稳定性:X<Z
C.Y和Z的最高价氧化物对应水化物均为强酸
D.若Z的最高正价为+m,则X的最高正价也一定为+m
查看答案和解析>>
科目:高中化学 来源:2014高考化学名师知识点精编 专题4氧化还原反应练习卷(解析版) 题型:选择题
根据表中信息,判断下列叙述中正确的是( )
序号 | 氧化剂 | 还原剂 | 其他反应物 | 氧化产物 | 还原产物 |
① |
| FeBr2 | / |
| Cl- |
② | KClO3 | 浓盐酸 | / | Cl2 |
|
③ | KMnO4 | H2O2 | H2SO4 | O2 | Mn2+ |
A.表中①组的反应可能有一种或两种元素被氧化
B.氧化性强弱的比较:KClO3>Fe3+>Cl2>Br2
C.表中②组反应的还原产物是KCl,电子转移数目是6NA
D.表中③组反应的离子方程式为:2MnO4—+3H2O2+6H+ 2Mn2++4O2↑+6H2O
2Mn2++4O2↑+6H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com