
| A、A、B的转化率之比为2:1 |
| B、m值为2 |
| C、在反应达到平衡前,正、逆反应速率均不断减小 |
| D、若温度和体积一定,则起始和最终压强之比为9:7 |
| 0.4mol |
| 0.6mol |
| 0.2mol |
| 0.3mol |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、体系的压强保持不变 |
| B、H2与I2的体积比保持不变 |
| C、混合气体的颜色保持不变 |
| D、每消耗1molH2的同时生成2molHI |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、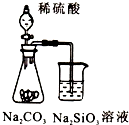 证明非金属性强弱:S>C>Si |
B、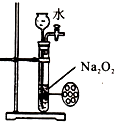 制备少量氧气并控制反应 |
C、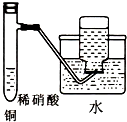 制备并收集少量NO气体 |
D、 量取0.10 mol?L-11KOH溶液20.00 mL |
查看答案和解析>>
科目:高中化学 来源: 题型:
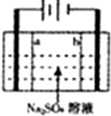 近来人们开发了通过电解同时生产NaOH和H2SO4的化学工艺,现在用离子交换膜(a、b)和石墨作电极的电解池进行生产NaOH和H2SO4,下列主产法中不正确的是( )
近来人们开发了通过电解同时生产NaOH和H2SO4的化学工艺,现在用离子交换膜(a、b)和石墨作电极的电解池进行生产NaOH和H2SO4,下列主产法中不正确的是( )| A、阴极反应式4OH--4e-=2H2O+O2↑ |
| B、阴极得到NaOH,阳极得到H2SO4 |
| C、每生产1molH2SO4,同时得到2mol NaOH |
| D、此反应实质就是电解水 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用丁达尔现象区别蔗糖溶液和淀粉溶液 |
| B、用燃着的木条鉴别CO2和O2 |
| C、用稀硫酸鉴别锌片和铜片 |
| D、用加水溶解的方法即可鉴别食盐和白糖 |
查看答案和解析>>
科目:高中化学 来源: 题型:
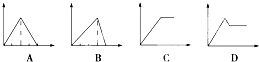
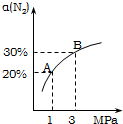 某温度下,对于反应N2(g)+3H2(g)?NH3(g);△H=-92.4kJ/mol.N2的平衡转化率(α)与体系总压强(P)的关系如图所示.下列说法正确的是( )
某温度下,对于反应N2(g)+3H2(g)?NH3(g);△H=-92.4kJ/mol.N2的平衡转化率(α)与体系总压强(P)的关系如图所示.下列说法正确的是( )| A、将1.0mol氮气、3.0mol氢气,置于1L密闭容器中发生反应,放出的热量为92.4kJ |
| B、平衡状态由A变到B时,平衡常数K(A)<K(B) |
| C、上述反应在达到平衡后,增大压强,H2的转化率提高 |
| D、保持压强不变,通入惰性气体,平衡常数不变,平衡不移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氢铝化合物与水反应生成氢氧化铝和氢气 |
| B、铝与水蒸气高温下反应生成氢铝化合物 |
| C、氢铝化合物中铝显+3价,氢显-1价 |
| D、氢铝化合物具有强还原性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氯气可使湿润的红布条退色,所以氯气具有漂白性 |
| B、在通常情况下,氯气可以和任何金属直接化合 |
| C、氯气没有漂白性,但通入品红溶液中,品红会退色 |
| D、氯气是黄绿色气体,闻其气味时要小心将集气瓶放在鼻孔下直接闻 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com