
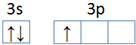
 ,第一电离能:镁大于(填“大于”或“小于”)铝.
,第一电离能:镁大于(填“大于”或“小于”)铝.
分析 I.(1)Al原子价电子排布式为3s23p1,根据泡利原理、洪特规则画出价电子排布图;Mg元素3s能级为全满稳定状态,第一电离能高于同周期相邻元素的;
(2)分子中碳原子均没有孤对电子,苯环中C原子形成3个σ键、其它碳原子生成4个σ键,杂化轨道数目分别为3、4;
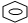
II.(3)钨元素位于周期表的第六周期第VIB族,据此书写其外围电子排布式;
(4)利用均摊法计算钨原子数目,以体内钨原子可知,1个钨原子周围距离钨原子最近的碳原子有6个,碳化钨晶胞中碳原子和钨原子所处位置为六方最密堆积,与Mg的堆积方式相同;
(5)计算结构中W、C原子数目,利用阿伏伽德罗常数表示出质量,再根据m=ρV计算.
解答 解:I.(1)Al原子价电子排布式为3s23p1,价电子排布图为,Mg元素3s能级为全满稳定状态,能量较低,Mg的第一电离能大于Al的,
故答案为: ;大于;
;大于;
(2)分子中碳原子均没有孤对电子,苯环中C原子形成3个σ键、其它碳原子生成4个σ键,杂化轨道数目分别为3、4,分别采取sp2、sp3 杂化,二者原子数目之比为12:6=2:1,
故答案为:sp2、sp3;2:1;
II.(3)钨元素位于周期表的第六周期第VIB族,其外围电子排布式为:5d46s2,
故答案为:5d46s2;
(4)在此结构中钨原子数目为1+2×$\frac{1}{2}$+12×$\frac{1}{6}$+6×$\frac{1}{3}$=6,以体内钨原子可知,1个钨原子周围距离钨原子最近的碳原子有6个,碳化钨晶胞中碳原子和钨原子所处位置为六方最密堆积,与Mg的堆积方式相同,
故答案为:6;6;C;
(5)结构中W原子数目为6、C原子数目为6,则结构质量为4×$\frac{Mg/mol}{{N}_{A}mo{l}^{-1}}$,则4×$\frac{Mg/mol}{{N}_{A}mo{l}^{-1}}$=Vcm3×b g/cm3,故NA=$\frac{4M}{bV}$,
故答案为:$\frac{4M}{bV}$.
点评 本题是对物质结构与性质的考查,涉及核外电子排布、杂化方式、晶胞结构与计算等,注意识记中学常见晶胞结构,掌握均摊法进行晶胞的有关计算,(3)中价电子书写为易错点,识记元素周期表中特殊情况.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题

 +Br2
+Br2
 +HO-NO2
+HO-NO2
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
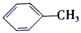 $→_{△}^{KMnO_{4}/H+}$
$→_{△}^{KMnO_{4}/H+}$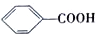
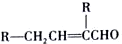
 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 高纯度的单晶硅可用于制造太阳能电池板和光导纤维 | |
| B. | 石油可以通过裂解、裂化等物理变化获得重要化工原料乙烯 | |
| C. | 鸡蛋清和淀粉溶液都属于胶体,遇到硫酸铜溶液可以发生胶体聚沉 | |
| D. | 植物油中由于含有碳碳双键,因此在空气中长时间放置容易氧化变质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
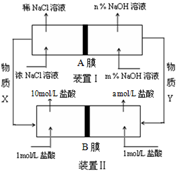 将氯碱工业与燃料电池联合能够有效降低能源消耗,如图是该工艺的图示(电源及电极未标出),则下列说法错误的是( )
将氯碱工业与燃料电池联合能够有效降低能源消耗,如图是该工艺的图示(电源及电极未标出),则下列说法错误的是( )| A. | 装置I为电解池,装置II为原电池 | |
| B. | 物质X为氯气,物质Y为氢气 | |
| C. | A膜为阳离子交换膜,B膜为阴离子交换膜 | |
| D. | 装置Ⅰ中,m小于n,装置II中a等于1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 陈述I | 陈述II |
| A | 油脂和汽油都是油 | 一定条件下都能发生皂化反应 |
| B | CuSO4可以用作游泳池消毒剂 | 铜盐能使蛋白质变性 |
| C | 蔗糖、淀粉、纤维素是还原性糖 | 它们一定条件下都能发生银镜反应 |
| D | 蛋白质结构中存在肽键 | 蛋白质能表现出两性 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
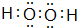 ,其所含化学键为(选代码)bc.
,其所含化学键为(选代码)bc.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=6,显弱酸性 | B. | [H+]=10-6mo1•L-1,溶液为中性 | ||
| C. | [OH-]=10-6mo1•L-1,溶液为碱性 | D. | 温度不变稀释10倍,pH=7 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com