
| A. | 3:2 | B. | 2:3 | C. | 4:1 | D. | 1:4 |
分析 25mlNO2和NO的混合气体通入倒立于水槽中盛满水的试管中,发生反应为3NO2+H2O=2HNO3+NO,充分反应后试管中剩下15ml气体应为NO,利用差量法计算二氧化氮气体的体积,再根据混合气体的体积计算一氧化氮气体的体积,从而确定其体积比.
解答 解:25mlNO2和NO的混合气体通入倒立于水槽中盛满水的试管中发生反应为3NO2+H2O=2HNO3+NO,剩余10ml气体,反应前后气体体积减少15ml,设二氧化氮气体的体积为V,
3NO2+H2O=2HNO3+NO△V(气体体积减少)
3 2
V(NO2) 10ml
3:2=V(NO2):10mL,
V(NO2)=$\frac{3×10ml}{2}$=15ml,
原气体中V(NO)=25mL-15mL=10mL,
所以原混合气体中NO和NO2的体积比为为V(NO2):V(NO)=15ml:10ml=3:2,则原混合气体中NO、NO2的体积比是2:3;
故选B.
点评 本题考查了根据方程式的计算,根据二氧化氮和气体体积减少的体积的关系,利用差量法来分析解答,难度不大.


 53天天练系列答案
53天天练系列答案科目:高中化学 来源: 题型:选择题
| A. | ①④ | B. | ①③ | C. | ②④ | D. | ②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 25.4ρ | B. | 12.7ρ | C. | 6.97ρ | D. | 6.35ρ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
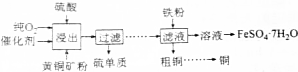
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 篮烷的分子式为C12H20 | |
| B. | 篮烷分子中存在2个六元环 | |
| C. | 篮烷分子中存在3个五元环 | |
| D. | 篮烷的一氯代物共有4种同分异构体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3F | B. | CCl4 | C. | COCl2 | D. | CH2ClCOOH. |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加催化剂 | B. | 降低温度 | C. | 减小压强 | D. | 加入O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com