
| A. | 实验①证明KClO3具有还原性 | |
| B. | 实验②中氧化剂与还原剂的物质的量之比为2:1 | |
| C. | 实验③说明KI被氧化 | |
| D. | 上述实验证明氧化性:ClO3->Cl2>I2 |
分析 ①向KClO3晶体中滴加浓盐酸,产生黄绿色气体,说明浓盐酸被氧化为氯气,因此实验①证明KClO3具有氧化性,发生KClO3+6HCl=3Cl2↑+KCl+3H2O;
②向NaI溶液中通入少量实验①产生的气体,溶液变黄色,生成I2,可使淀粉KI试纸变蓝,发生2I-+Cl2=I2+2Cl-,
氧化还原反应中,氧化剂+还原剂=氧化产物+还原产物,氧化性:氧化剂>氧化产物,还原性:还原剂>还原产物,以此解答该题.
解答 解:A.向KClO3晶体中滴加浓盐酸,产生黄绿色气体,说明浓盐酸被氧化为氯气,因此实验①证明KClO3具有氧化性,故A错误;
B.向NaI溶液中通入少量实验①产生的气体,溶液变黄色,生成I2,可使淀粉KI试纸变蓝,发生2I-+Cl2=I2+2Cl-,氧化剂与还原剂的物质的量之比为1:2,故B错误;
C.向NaI溶液中通入少量实验①产生的气体,溶液变黄色,生成I2,可使淀粉KI试纸变蓝,但KI没有被氧化,故C错误;
D.根据氧化剂+还原剂=氧化产物+还原产物,氧化性:氧化剂>氧化产物,还原性:还原剂>还原产物,则由反应①可知氧化性KClO3>Cl2,由反应②可知Cl2>I2,则可得氧化性ClO3->Cl2>I2,故D正确.
故选D.
点评 本题考查氯气的化学性质,题目难度不大,在学习中要注意比较氧化性、还原性的方法,氧化还原反应电子守恒的利用等问题.


 精英口算卡系列答案
精英口算卡系列答案 应用题点拨系列答案
应用题点拨系列答案科目:高中化学 来源: 题型:选择题
| A. | 0.15 mol/(L•S) | B. | 0.3 mol/(L•S) | C. | 0.6 mol/(L•S) | D. | 0.9 mol/(L•S) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 遇碘单质是否变蓝-淀粉和纤维素 | |
| B. | 遇浓硝酸是否变黄-某些蛋白质和油脂 | |
| C. | 与氯气混合后光照,气体颜色是否逐渐变浅-甲烷和乙烷 | |
| D. | 与新制的氢氧化铜共热是否产生砖红色沉淀-葡萄糖和蔗糖 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
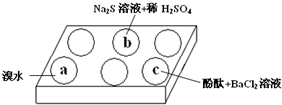 在白色点滴板上进行Na2SO3 的性质实验探究.如图所示,a、b、c三个凹槽中滴有Na2SO3 溶液,再分别滴加下图所示的试剂:
在白色点滴板上进行Na2SO3 的性质实验探究.如图所示,a、b、c三个凹槽中滴有Na2SO3 溶液,再分别滴加下图所示的试剂:| n(SO3 2-):n(HSO3-) | 91:9 | 1:1 | 9:91 |
| pH | 8.2 | 7.2 | 6.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH2═CH2+HCl→CH3CH2Cl | B. |  +HO-NO2$→_{55~60℃}^{浓H_{2}SO_{4}}$ +HO-NO2$→_{55~60℃}^{浓H_{2}SO_{4}}$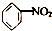 +H2O +H2O | ||
| C. | nCH2═CH2$\stackrel{一定条件}{→}$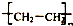 | D. | (C6H10O5)n+nH2O$\stackrel{一定条件}{→}$nC6H12O6 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若化合物M其原子个数比为14:4:5:1:1,则其化学式为[Cu(NH3)4]SO4•H2O | |
| B. | 若该化合物为配合物,则E离子给出孤对电子 | |
| C. | C元素与D元素形成的一种具有较强还原性的分子的VSEPR模型为平面三角形 | |
| D. | DC42-空间构型为正四面体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
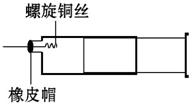 某同学采用如图装置进行实验,证明了铜与稀硝酸反应生成了NO.实验时,先向注射器内加入一定量的稀硝酸,排净注射器内的空气,迅速将带有铜丝的橡皮帽盖上,一段时间后,注射器内有无色气体产生.
某同学采用如图装置进行实验,证明了铜与稀硝酸反应生成了NO.实验时,先向注射器内加入一定量的稀硝酸,排净注射器内的空气,迅速将带有铜丝的橡皮帽盖上,一段时间后,注射器内有无色气体产生.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
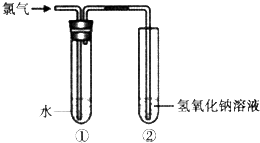 某同学用如图所示装置制取氯水并进行相关实验.
某同学用如图所示装置制取氯水并进行相关实验.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com