
下列表示对应化学反应的离子方程式,正确的是
A.氯气溶于水:Cl2+H2O=2H++Cl-+ClO-
B.硝酸亚铁溶液中滴加少量稀硫酸:Fe2++NO3-+4H+=Fe3++NO↑+2H2O
C.把反应Cu+2FeCl3=2FeCl2+CuCl2设计成原电池,其正极反应为Fe3++e-=Fe2+
D.向硫酸氢钠溶液中加入氢氧化钡溶液至中性,则离子方程式为H++SO42-+OH-=BaSO4↓+H2O
科目:高中化学 来源:2017届河南省高三上学期第一次月考化学试卷(解析版) 题型:选择题
以a g KNO3溶于b g水,形成VmL饱和溶液。下列关系式错误的是( )
A.KNO3物质的量浓度: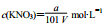
B.20℃时KNO3的溶解度
C.KNO3质量分数:
D.该溶液的密度
查看答案和解析>>
科目:高中化学 来源:2016-2017学年湖南省高一上第二次月考化学卷(解析版) 题型:选择题
利用含碳化合物合成燃料是解决能源危机的重要方法,已知CO(g)+2H2(g) CH3OH(g)反应过程中的能量变化情况如图所示,曲线Ⅰ和曲线Ⅱ分别表示不使用催化剂和使用催化剂的两种情况。下列判断正确的是 ( )
CH3OH(g)反应过程中的能量变化情况如图所示,曲线Ⅰ和曲线Ⅱ分别表示不使用催化剂和使用催化剂的两种情况。下列判断正确的是 ( )
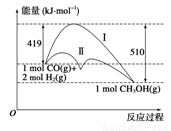
A.该反应的ΔH=+91 kJ·mol-1
B.加入催化剂,该反应的ΔH变小
C.反应物的总能量小于生成物的总能量
D.如果该反应生成液态CH3OH,则ΔH减小
查看答案和解析>>
科目:高中化学 来源:2016-2017学年湖南省高一上第二次月考化学卷(解析版) 题型:选择题
下列说法正确的是 ( )
A. ⅠA族元素的金属性比ⅡA族元素的金属性强
B. ⅥA族元素的氢化物中,稳定性最好的其沸点也最高
C. 同周期非金属氧化物对应的水化物的酸性从左到右依次增强
D. 第三周期元素的离子半径从左到右逐渐减小
查看答案和解析>>
科目:高中化学 来源:2017届贵州省、贵阳一中高三上月考化学试卷(解析版) 题型:填空题
运用化学反应原理消除工业污染,保护生态环境具有非常重要的意义。
(1)采取热还原法,用碳粉可将氮氧化物还原。
已知:①N2(g)+O2(g)=2NO(g) △H=+180.6kJ·mol-1;
②C(s)+O2(g)=CO2(g) △H=-393.5kJ·mol-1。
则反应C(s)+2NO(g)=CO2(g)+N2(g) △H= kJ·mol-1。
(2)在催化剂作用下,将nmolSO2与nmolCl2充入容积可变的密闭容器中,发生反应:SO2(g)+ Cl2(g)  SO2Cl2(g)(硫酰氯),并始终保持温度为T,压强为p。起始时气体总体积为10L,tmin时反应达到平衡状态,此时气体总体积为8L。
SO2Cl2(g)(硫酰氯),并始终保持温度为T,压强为p。起始时气体总体积为10L,tmin时反应达到平衡状态,此时气体总体积为8L。
①在容积改变的条件下,反应速率可用单位时间内反应物或生成物的物质的量变化来表示。则v(SO2)= ___ mol/min。
②此温度下,该反应的K= 。
③相同条件下,若将0.5nmolSO2与0.5nmolCl2充入该容器,到达平衡状态时,混合物中SO2Cl2的物质的量是 。
(3)利用氨水可以将SO2和NO2吸收,原理如图所示:
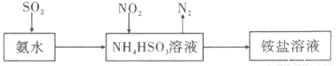
NO2被吸收的离子方程式是 。
(4)利用如下图所示装置(电极均为惰性电极)也可吸收SO2,并用阴极排出的溶液吸收NO2。
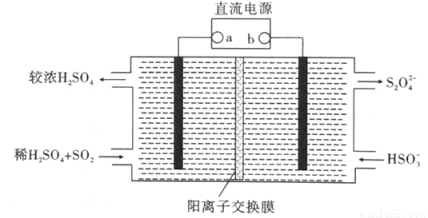
①阴极的电极反应式为 。
②在碱性条件下,用阴极排除的溶液吸收NO2,使其转化为无害气体,同时有SO32-生成。该反应的离子方程式为 。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年黑龙江牡丹江高级中学高二9月月考化学卷(解析版) 题型:填空题
I.工业上利用H2和CO2合成二甲醚的反应如下:6H2(g)+2CO2(g)  CH3OCH3(g)+3H2O(g) ΔH<0
CH3OCH3(g)+3H2O(g) ΔH<0
温度升高,该化学平衡移动后到达新的平衡,CH3OCH3的产率将________(填“变大”、“变小”或“不变”,下同),混合气体的平均相对分子质量将________;
Ⅱ.某科研小组欲研究在其他条件不变的情况下,改变起始氧气的物质的量对合成新型硝化剂反应 4NO2(g)+O2(g)  2N2O5(g) ΔH<0的影响。
2N2O5(g) ΔH<0的影响。

(1)图像中T1和T2的关系是T1________T2(填“>”、“<”或“=”);
(2)比较a、b、c三点所处的平衡状态中,反应物NO2的转化率最大的是________(填字母);
(3)若起始时NO2是4mol,容器体积为1 L,n=1 mol,NO2的转化率为50%,则此条件下(T2),反应的平衡常数为_________________。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年黑龙江牡丹江高级中学高二9月月考化学卷(解析版) 题型:选择题
合成氨反应:N2(g)+3H2(g)  2NH3(g) ΔH=-92.4 kJ·mol-1,在反应过程中,正反应速率的变化如图:下列说法正确的是
2NH3(g) ΔH=-92.4 kJ·mol-1,在反应过程中,正反应速率的变化如图:下列说法正确的是

A.t1时升高了温度 B.t2时使用了催化剂 C.t3时增大了压强 D.t4时降低了温 度
度
查看答案和解析>>
科目:高中化学 来源:2016-2017学年黑龙江牡丹江高级中学高一9月月考化学卷(解析版) 题型:选择题
关于0.1 mol·L-1 Na2CO3溶液的叙述错误的是
A.0.5 L该溶液中钠离子的物质的量浓度为0.2 mol·L-1
B.1 L该溶液 中含Na2CO3的质量为10.6 g
中含Na2CO3的质量为10.6 g
C.从1 L该溶液中取出100 mL,则取出溶液中Na2CO3的物质的量浓度为0.01 mol·L-1
D .取该溶液10 mL,加水稀释至100 mL后,Na2CO 3的物质的量浓度为0.01 mol·L-1
3的物质的量浓度为0.01 mol·L-1
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河北省高一上9.18周考化学卷(解析版) 题型:实验题
根据要求完成下列各小题实验目的。(a、b为弹簧夹,加热及固定装置已略去)

(1)验证碳、硅非金属性的相对强弱。(已知酸性:亚硫酸>碳酸)
① 连接仪器、__________、加药品后,打开。关闭b,然后滴入浓硫酸,加热。
② 铜与浓硫酸反应的化学方程式是_____________,装置A中的试剂是____________。
③ 能说明碳的非金属性比硅强的实验现象是:_________________。
(2)验证SO2的氧化性、还原性和酸性氧化物的通性。
① 打开b,关闭a。能验证SO2具有氧化性的化学方程式是:______________。
② 若大量的SO2通入NaOH溶液中,其化学方程式是:_______________。
③ BaCl2溶液中无沉淀现象,将其分成两份,分滴加下列溶液,将产生的沉淀的化学式填入下表相应位置。

写出其中SO2显示还原性并生成沉淀的离子方程式_____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com