
| 74.5g/mol×3mol |
| 282g |
| 3 |
| 4 |
| 1 |
| 4 |


科目:高中化学 来源: 题型:
| A、氨气的燃烧热为-316.3kJ?mol-1,则氨气燃烧的热化学方程式可表示为:4NH3(g)+3O2(g)=2N2(g)+6H2O(g)△H=-316.3kJ?mol-1 |
| B、500℃、30MPa下,将0.5mol N2(g)和1.5mol H2(g)置于密闭的容器中充分反应NH3(g),放热19.3kJ,其热化学方程式为:N2 (g)+3H2(g)═2NH3(g)△H=-38.6kJ?mol-1 |
| C、由C(石墨)=C(金刚石)△H=+1.90kJ?mol-1,可知金刚石比石墨稳定 |
| D、由H+(aq)+OH-(aq)=H2O(l)△H=-57.3kJ?mol-1,可知将含0.5mol H2SO4的浓溶液与含1mol NaOH的稀溶液混合,放出的热量大于57.3 kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、一定条件下,162g淀粉水解得到葡萄糖的分子数为n倍NA |
| B、1mol C10H22分子中共价键总数为31NA |
| C、室温下,4.4g乙醛和乙酸乙酯的混合物含有的碳原子数为0.2NA |
| D、88.0g干冰中含有的共用电子对对数为8NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、锌与稀硫酸:Zn+2H+═Zn2++H2↑ |
| B、氢氧化钾与氯化镁两溶液混合:2OH-+Mg2+═Mg(OH)2↓ |
| C、钠跟水反应:Na+2H2O═Na++2OH-+H2↑ |
| D、大理石与稀硝酸:CaCO3+2H+═Ca2++CO2↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
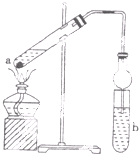 如图,在试管a中先加入2ml.95%的乙醇,加摇边缓缓加入2ml浓硫酸,再加入3ml.无水醋酸,用玻璃棒充分搅拌后将试管固定在铁架台上,在试管b中加入7ml.饱和碳酸钠溶液,连接好装置.用酒精灯对试管a加热.当观察到试管b中有明显现象时停止实验.
如图,在试管a中先加入2ml.95%的乙醇,加摇边缓缓加入2ml浓硫酸,再加入3ml.无水醋酸,用玻璃棒充分搅拌后将试管固定在铁架台上,在试管b中加入7ml.饱和碳酸钠溶液,连接好装置.用酒精灯对试管a加热.当观察到试管b中有明显现象时停止实验.查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| Fe3+ | Fe2+ | Cu2+ | Al3+ | |
| 开始沉淀时pH | 2.2 | 7.5 | 5.2 | 3.7 |
| 完全沉淀时pH | 3.2 | 9.0 | 6.7 | 4.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com