

分析 (1)二氧化硫用碘溶液来吸收生产历史和碘化氢,测定SO2含量,除测定气体流速(单位:cm3•min-1)外,还需要测定溶液蓝色恰好褪去所需的时间,要测可吸入颗粒的含量,可用颗粒吸附剂来吸收,颗粒吸附剂前后质量之差即为可吸入颗粒的质量,则应测定吸收前后颗粒吸附剂、棉花、盛放容器的总质量;准确称取碘单质的质量=1L×l×10-2 mol•L-1 ×254g/mol=2.54g,碘单质加入烧杯中,同时还应加入少量碘化钾固体,依据配制100ml溶液的步骤选择需要的玻璃仪器;
(2)①依据化学方程式定量关系计算,SO2+I2+2H2O=H2SO4+2HI;
②如果抽气速度过快,部分二氧化硫可能来不及和碘水反应;如果装置漏气时,部分二氧化硫会逸散出广口瓶.
解答 解:(1)①二氧化硫用碘溶液来吸收,反应的化学方程式为:SO2+I2+2H2O═2HI+H2SO4,
故答案为:SO2+I2+2H2O═2HI+H2SO4;
②要测可吸入颗粒的含量,可用颗粒吸附剂来吸收,颗粒吸附剂前后质量之差即为可吸入颗粒的质量,则应测定吸收前后颗粒吸附剂、棉花、盛放容器的总质量,测定SO2含量,除测定气体流速(单位:cm3•min-1)外,还需要测定溶液蓝色恰好褪去所需的时间,
故答案为:装置A在反应前后的质量或吸收前后颗粒吸附剂、棉花、玻璃管(盛放容器)的总质量;
③第一步:为配制精确浓度的溶液,先要配制1000mLl×10-2 mol•L-1碘溶液,再取5.00mL溶液稀释成为5×10-4mol•L-1碘溶液.计算需要称量碘单质的质量=1L×l×10-2 mol•L-1 ×254g/mol=2.54g,
故答案为:2.54;
第二步:由题意可知碘单质微溶于水,KI可以增大碘在水中的溶解度,则准确称取2.54g碘单质加入烧杯中,同时还应加入少量碘化钾固体,加适量水搅拌使之完全溶解,则第二步操作应将第一步所得溶液全部转入1000 mL的容量瓶中,定容,摇匀,
则从第二步所得溶液中,取出10.00mL溶液于100mL容量瓶中,加水稀释至刻度线,可得碘溶液,
故答案为:将第一步所得溶液全部转入1000 mL的容量瓶中;
第三步:用第二步所得溶液配制5×10-4mo1•L-1碘溶液100ml,此步操作中,除烧杯、玻璃棒、胶头滴管外还需要的玻璃仪器有移液管(或酸式滴定管) 100mL容量瓶,
故答案为:移液管(或酸式滴定管) 100mL容量瓶;
(2)①碘单质物质的量=0.050L×5×10-4mol/L=2.5×10-5mol,
SO2+I2+2H2O=H2SO4+2HI
二氧化硫物质的量为2.5×10-5mol,
质量为2.5×10-5mol×64g/moL=1.6×10-3g,
以200mL•s-1气体流速通过气体流速管通入到上图实验装置中,观察记录碘溶液褪色所需时间为500s,体积=200mL•s-1×500s=100000ml,所以空气中SO2的含量为$\frac{1.6×1{0}^{-3}g}{100L}$g/cm3=0.016mg/L,空气中二氧化硫的最大允许排放浓度不得超过0.02mg•L-1,则此气体符合排放标准,
故答案为:0.016;符合;
②如果抽气速度过快,部分二氧化硫可能来不及和碘水反应,从而导致测得的数值比实际含量低;
吸收不完全测定结果会偏低;
如果装置漏气时,部分二氧化硫会逸散出广口瓶,从而导致测得的数值比实际含量低.
故答案为:气体流速过快,吸收不完全(或未充分反应);装置气密性较差.
点评 本题考查了物质组成的实验探究分析、溶液配制过程、气体含量计算、误差分析应用等知识,掌握基础是解题关键,题目难度中等.


科目:高中化学 来源: 题型:解答题

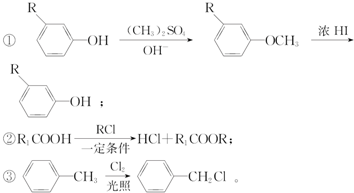
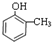 .
.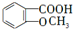 +
+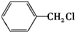 $\stackrel{一定条件}{→}$
$\stackrel{一定条件}{→}$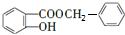 +HCl.
+HCl.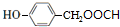 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
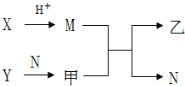 已知A、B、C、D为短周期内原子半径依次增大的元素,X、Y、M、N分别由这四种元素中的两种组成的常见化合物,甲、乙为其中两种元素对应的单质.若X与Y、甲与乙摩尔质量相同,Y与乙均为淡黄色固体,上述物质之间的转化关系如下图所示(部分反应物或生成物省略),则下列说法中不正确的是( )
已知A、B、C、D为短周期内原子半径依次增大的元素,X、Y、M、N分别由这四种元素中的两种组成的常见化合物,甲、乙为其中两种元素对应的单质.若X与Y、甲与乙摩尔质量相同,Y与乙均为淡黄色固体,上述物质之间的转化关系如下图所示(部分反应物或生成物省略),则下列说法中不正确的是( )| A. | 相对分子质量M>N,沸点N>M | |
| B. | A、C、D的常见氧化物相互之间一定能反应 | |
| C. | 简单离子半径:C2->B2->D+>A+ | |
| D. | D与其他元素均能形成离子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 有A、B、C、D四种含14个电子的粒子,其结构特点如下:
有A、B、C、D四种含14个电子的粒子,其结构特点如下:| 粒子代码 | A | B | C | D |
| 原子核数目 | 单核 | 不同元素构成的两核 | 同种元素构成的两核 | 同种元素构成的两核 |
| 粒子所带电荷数 | 0 | 0 | 0 | 两个负电荷 |
| 选项 | a | b | c | d |
| x | 温度 | 温度 | 加入H2的物质的量 | 加入甲的物质的量 |
| y | 混合气体的平均相对分子质量 | 平衡常数K | 混合气体的密度 | 达平衡时的甲的转化率 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在标准状况下,0.5 molNO与0.5 molO2混合后气体分子数为0.75 NA | |
| B. | 某温度下纯水的pH=6,该温度下10 L pH=11的NaOH溶液中含OH-的数目为NA | |
| C. | 0.1molAlCl3完全转化为氢氧化铝胶体,生成O.l NA个胶体粒子 | |
| D. | 以Mg、Al为电极,NaOH溶液为电解质溶液的原电池中,导线上流过NA个电子,则正极放出H2的体积为11.2 L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分离物质的量之比为1:6的氯化钠和硝酸钾混合物时,可先将样品溶解,然后加热至表面出现晶膜后冷却,过滤得到硝酸钾晶体;将母液加热至有大量晶体析出后,用余热蒸干,得氯化钠晶体 | |
| B. | 在“反应热的测量和计算”实验时须先将用于实验的等体积等物质的量的稀NaOH和稀HCl溶液置于相同温度(一般为25℃)下保温一段时间后再混合 | |
| C. | 在电化学实验中常使用碳电极,实验室一般采用多孔碳棒作为碳电极.有些电化学反应中的气体产物可以自由填充在多孔碳棒的疏松空隙中,从而降低反应池的极性,提高电流效率 | |
| D. | 在实验中观察到的物质的颜色可能会与其理论颜色有一定的偏差,如通过Cu和浓HNO3反应制得的Cu(NO3)2溶液中因溶有少量NO2而显黄色,苯酚因被空气中的O2氧化而显粉红色. |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验序号 | 待测液体积(mL) | 所消耗盐酸标准液的体积(mL) | |
| 滴定前 | 滴定后 | ||
| 1 | 20.00 | 0.50 | 20.52 |
| 2 | 20.00 | 8.00 | 26.00 |
| 3 | 20.00 | 1.40 | 21.38 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2SO3+ClO-→2 H++SO42-+Cl- | B. | SO2+ClO-+H2O→2 H++SO42-+Cl- | ||
| C. | SO2+ClO-+H2O→SO32-+HClO | D. | SO2+ClO-+2OH-→SO42-+Cl-+H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com