
���� ��1��������������Na2A��ˮ���Լ��ԣ�����ˮ���Ե�һ��Ϊ����
��2���ɷ�ӦʽBa2++A2-=BaA���ɵã�������A2-����0.01mol����Һ��c��A2-��=$\frac{0.01mol}{30��1{0}^{-3}L}$=$\frac{1}{3}$mol•L-1������BaA��Ksp�ɵ�c��Ba2+����
��3������c��OH-��=$\sqrt{\frac{Ksp}{c��M{g}^{2+}��}}$��������������Ũ�ȣ��Ӷ�ȷ����Һ��pH�����ݻ����Һ������������Ũ�������ɳ���ʱ����pH���бȽ��жϣ�
��� �⣺��1��������������Na2A��ˮ���Լ��ԣ�pH��7������ˮ���Ե�һ��Ϊ����������Ũ�ȹ�ϵΪc��Na+����c��A2-����c��OH-����c��HA-����c��H+����
�ʴ�Ϊ������c��Na+����c��A2-����c��OH-����c��HA-����c��H+����
��2���ɷ�ӦʽBa2++A2-=BaA���ɵã�������A2-����0.01mol����Һ��c��A2-��=$\frac{0.01mol}{30��1{0}^{-3}L}$=$\frac{1}{3}$mol•L-1������BaA��Ksp=c��Ba2+��•c��A2-���ɵ�c��Ba2+��=$\frac{Ksp}{c��{A}^{2-}��}$=$\frac{1.8��1{0}^{-10}}{\frac{1}{3}}$=5.4��10-10 mol•L-1��
�ʴ�Ϊ��5.4��10-10��
��3��c��OH-��=$\sqrt{\frac{Ksp}{c��M{g}^{2+}��}}$=$\sqrt{\frac{2��1{0}^{-11}}{0.002}}$mol/L=10-4 mol/L����c��H+��=10-10 mol/L��������Һ��pH=10����0.20L��0.002mol•L-1MgSO4��Һ�м���������0.10mol•L-1�İ�ˮ��Һ�����谱ˮ�ĵ���̶Ȳ��䣬������Һ������������Ũ��=$\sqrt{20}$��10-3 mol/L=4.45��10-3 mol/L��10-4 mol/L�������г������ɣ�
�ʴ�Ϊ��10���У�
���� ���⿼���Ϊ�ۺϣ��漰������ʵĵ��롢��ѧƽ�⡢���ܵ���ʵ��ܽ�ƽ�⡢����ˮ���֪ʶ�㣬�Ѷ��еȣ�������ʵĵ���ƽ�⡢��ѧƽ���Ǹ߿����ȵ㣬Ӧ�������գ�


 �̲�ȫ���ִʾ�ƪϵ�д�
�̲�ȫ���ִʾ�ƪϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 ����ϩ���������Ϻͺϳ�����Ҫ�����л�ԭ�ϣ��ұ������ⷨ��Ŀǰ��������������ϩ����Ҫ�������仯ѧ����ʽΪ��
����ϩ���������Ϻͺϳ�����Ҫ�����л�ԭ�ϣ��ұ������ⷨ��Ŀǰ��������������ϩ����Ҫ�������仯ѧ����ʽΪ��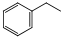 ��g��$?_{���£�T��}^{Fe_{2}O_{3}}$
��g��$?_{���£�T��}^{Fe_{2}O_{3}}$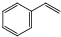 ��g��+H2��g����H=+120kJ•mol-1
��g��+H2��g����H=+120kJ•mol-1�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | Fe2O3+3CO=2Fe+3CO2��H=-28.5kJ•mol-1�������� | |
| B�� | Fe2O3��s��+3CO��g��=2Fe��s��+3CO2��g����H=-28.5kJ | |
| C�� | Fe2O3��s��+3CO��g��=2Fe��s��+3CO2��g����H=+28.5kJ•mol-1 | |
| D�� | Fe2O3��s��+3CO��g��=2Fe��s��+3CO2��g����H=-28.5kJ•mol-1�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ֻ����11 | B�� | ֻ����24 | C�� | ������29 | D�� | ������11��15 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
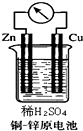 ��ͼ��ʾ��ͭ-пԭ����У�������Ӧ�۲쵽�������ǣ�
��ͼ��ʾ��ͭ-пԭ����У�������Ӧ�۲쵽�������ǣ��鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | KOH��CaCl2�Ⱥ������Ӽ����ֺ��й��ۼ� | |
| B�� | PH3��ԭ�Ӿ�����8�����ȶ��ṹ | |
| C�� | �����ӵĽṹʾ��ͼ�� | |
| D�� | NH4Cl�ĵ���ʽ��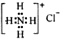 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | BF3��CCl4 | B�� | CO2��BeCl2 | C�� | NH4+��H3O+ | D�� | O3��SO3 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
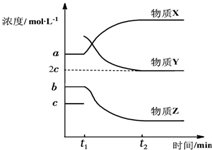
 ��ҵ�Ϻϳɼ״��ķ�ӦΪ��CO��g��+2H2��g��?CH3OH��g����H��0.500�棬5MPa�����£���0.20mol CO��0.58mol H2�Ļ���������2L�����ܱ�����������Ӧ����Ӧ�����м״������ʵ���Ũ����ʱ��ı仯��ͼ��ʾ
��ҵ�Ϻϳɼ״��ķ�ӦΪ��CO��g��+2H2��g��?CH3OH��g����H��0.500�棬5MPa�����£���0.20mol CO��0.58mol H2�Ļ���������2L�����ܱ�����������Ӧ����Ӧ�����м״������ʵ���Ũ����ʱ��ı仯��ͼ��ʾ�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com