
【题目】阿伏加德罗常数的值为NA。下列说法正确的是
A. 7.8 g Na2O2中含有的阴离子数为0.2NA。
B. 1 mol Fe溶于过量硝酸,电子转移数为2NA
C. 22.4 L(标准状况下)氩气含有的质子数为18NA
D. 标准状况下,2.24 L N2和O2的混合气体中分子数为0.2NA
科目:高中化学 来源: 题型:
【题目】下图是实验室制备氯气并进行一系列相关实验的装置(夹持及加热仪器已略)。
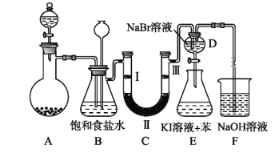
(1) 制备氯气选用的药品为固体二氧化锰和浓盐酸,则相关的化学反应方程式为:_____________。
装置B中饱和食盐水的作用是___________________;同时装置B亦是安全瓶,监测实验进行时C中是否发生堵塞,请写出发生堵塞时B中的现象____________________________________。
(2) 装置C的实验目的是验证氯气是否具有漂白性,为此C中Ⅰ、Ⅱ、Ⅲ依次放入__________。
a | b | c | d | |
Ⅰ | 干燥的有色布条 | 干燥的有色布条 | 湿润的有色布条 | 湿润的有色布条 |
Ⅱ | 碱石灰 | 硅胶 | 浓硫酸 | 无水氯化钙 |
Ⅲ | 湿润的有色布条 | 湿润的有色布条 | 干燥的有色布条 | 干燥的有色布条 |
(3) 设计装置D、E的目的是比较氯、溴、碘单质的氧化性强弱。当向D中缓缓通入少量氯气时,离子反应方程为:_______________________,打开活塞,将装置D中少量溶液加入装置E中,振荡。观察到的现象是__________________________________。
(4)装置F中用足量的NaOH溶液吸收余氯,试写出相应的离子方程式:_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将3.2 g铜粉与一定量的浓硝酸反应,当铜粉完全反应时收集到气体1.12 L(标准状况下)。则所消耗硝酸的物质的量是( )
A. 0.55mol B. 0.15 mol C. 0.3 mol D. 0.11mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】砷(As)是第四周期ⅤA族元素,可以形成As2S3、As2O5、H3AsO3、H3AsO4等化合物,有着广泛的用途。回答下列问题:
(1)画出砷的原子结构示意图____________;
(2)工业上常将含砷废渣(主要成分为As2S3)制成浆状,通入O2氧化,生成H3AsO4和单质硫。写出发生反应的化学方程式_______________________________________;
(3)已知:As(s)+![]() H2(g)+2O2(g)=H3AsO4(s) ΔH1
H2(g)+2O2(g)=H3AsO4(s) ΔH1
H2(g)+![]() O2(g)=H2O(l) ΔH2
O2(g)=H2O(l) ΔH2
2As(s)+![]() O2(g) =As2O5(s) ΔH3
O2(g) =As2O5(s) ΔH3
则反应As2O5(s) +3H2O(l)= 2H3AsO4(s)的ΔH =__________________;
(4)298 K时,将20 mL 3x mol·L1 Na3AsO3、20 mL 3x mol·L1 I2和20 mL NaOH溶液混合,发生反应:![]() (aq)+I2(aq)+2OH(aq)
(aq)+I2(aq)+2OH(aq)![]()
![]() (aq)+2I(aq)+ H2O(l)。溶液中c(
(aq)+2I(aq)+ H2O(l)。溶液中c(![]() )与反应时间(t)的关系如图所示。
)与反应时间(t)的关系如图所示。
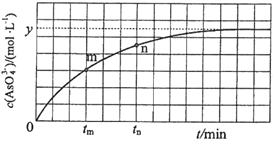
①下列不可判断反应达到平衡的是__________(填标号);
a.溶液的pH不再变化 b.v(I)=2v(![]() )
)
c.c(![]() )/c(
)/c(![]() )不再变化 d.c(I)=y mol·L1
)不再变化 d.c(I)=y mol·L1
②tm时,v逆_____ v正(填“大于”“小于”或“等于”);
③tn时v逆_____ tm时v逆(填“大于”“小于”或“等于”);
④若平衡时溶液的pH=14,则该反应的平衡常数K为___________;
(5)H3AsO3和H3AsO4水溶液中含砷的各物种的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与pH的关系分别如图- 1和图- 2所示:
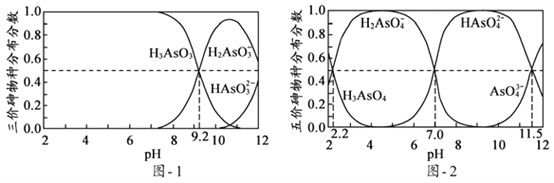
①以酚酞为指示剂(变色范围pH 8.0 ~ 10.0),将NaOH溶液逐滴加入到H3AsO3溶液中,当溶液由无色变为浅红色时停止滴加。该过程中主要反应的离子方程式为____________;
②H3AsO4第一步电离方程式H3AsO4![]() H2AsO4-+H+的电离常数为Ka1,则pKa1=_________(p Ka1 = -lg Ka1 );
H2AsO4-+H+的电离常数为Ka1,则pKa1=_________(p Ka1 = -lg Ka1 );
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一无色溶液,其中可能含有Fe3+、Al3+、Fe2+、Mg2+、Cu2+、NH4+、K+、CO32-、SO42-等离子的几种,为分析其成分,取此溶液分别进行了四个实验,其操作和有关现象如图所示:

请你根据上图推断:
(1)原溶液中一定存在的阴离子有_______________,显___(填“酸”“碱”或“中”)性。
(2)实验③中产生无色无味气体所发生的化学方程式为__________________________________。
(3)写出实验④中A点对应沉淀的化学式:__________。
(4)写出实验④中,由A→B过程中所发生反应的离子方程式:________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由两种元素组成的矿物A,测定A的组成及制取化合物D的流程如下:
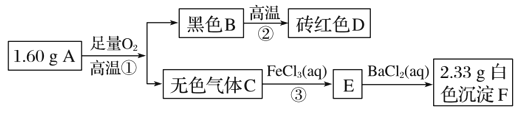
请回答:
(1)A的化学式为________________________。
(2)写出②的化学方程式:__________________。
(3)写出③的离子方程式:_________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】肉桂酸甲酯(H)常用作食用香精。用芳香烃A为原料先合成肉桂酸G(![]() ),继而合成H的路线如下:
),继而合成H的路线如下:
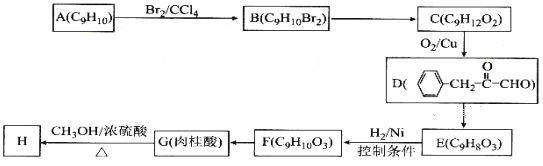
请回答下列问题:
(1)化合物A的结构简式为__________,D中含有官能团的名称为__________;
(2)B→C所加试剂的名称是__________,F→G的反应类型为__________;
(3)G→ H的化学方程式为__________;
(4)1 mol F最多与__________mol H2发生加成反应;
(5)写出与肉桂酸互为同分异构体,且能使溴的四氯化碳溶液褪色,还能与碳酸氢钠溶液反应的所有同分异构体的结构简式__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】若NA表示阿伏加德罗常数,下列有关叙述错误的是( )
A. 一定条件下,2molSO2和1molO2混合在密闭容器中充分反应后容器中的分子数大于2NA
B. 1 mol Na与O2完全反应,生成Na2O和Na2O2的混合物,转移电子总数为NA个
C. 16 g CH4与18 g NH4+ 所含电子数均为10NA
D. 溶液中含氯化铁1mol,完全转化为氢氧化铁胶体后,胶粒数为NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com