
雄黄(As4S4)和雌黄(As2S3)是提取砷的主要矿物原料,二者在自然界中共生。根据题意完成下列填空:
(1) As2S3和SnCl2在盐酸中反应转化为As4S4和SnCl4并放出H2S气体。若As2S3和SnCl2正好完全反应,As2S3和SnCl2的物质的量之比为 。
(2)上述反应中的氧化剂是 ,反应产生的气体可用 吸收。
(3) As2S3和HNO3有如下反应:As2S3+ 10H++ 10NO3—=2H3AsO4+ 3S+10NO2↑+ 2H2O
若生成2mol H3AsO4,则反应中转移电子的物质的量为 。若将该反应设计成一原电池,则NO2应该在 (填“正极”或“负极”)附近逸出。
(4)若反应产物NO2与11.2L O2(标准状况)混合后用水吸收全部转化成浓HNO3,然后与过量的碳反应,所产生的CO2的量 (选填编号)。
a.小于0.5 mol b.等于0.5 mol c.大于0.5mol d.无法确定
 新思维假期作业暑假吉林大学出版社系列答案
新思维假期作业暑假吉林大学出版社系列答案 蓝天教育暑假优化学习系列答案
蓝天教育暑假优化学习系列答案科目:高中化学 来源: 题型:
化合物Ⅴ是中药黄芩中的主要活性成分之一,具有抗氧化和抗肿瘤作用。化合物Ⅴ也可通过下图所示方法合成:
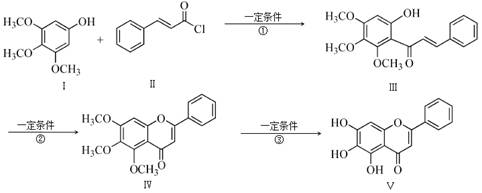
回答下列问题:
(1)化合物Ⅲ的分子式为 ,1 mol该物质完全燃烧需消耗 mol O2.
(2)化合物Ⅱ的合成方法为:
|
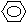 -CHO+(CH3CO)2O →
-CHO+(CH3CO)2O →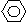
 -CH=CHCOOH+ A
-CH=CHCOOH+ A
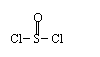 |
|

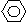
 -CH=CHCOOH 化合物Ⅱ
-CH=CHCOOH 化合物Ⅱ 已知在合成肉桂酸的化学反应中,反应物的物质的量之比为1︰1,生成物A可与饱和NaHCO3溶液反应产生气体,则生成物A的结构简式是 。
(3)反应①的反应类型为 。化合物Ⅰ和Ⅱ反应还可以得到一种酯,生成该酯的反应方程式为 。(不用注明反应条件)
(4)下列关于化合物Ⅳ、Ⅴ的说法正确的是 (填序号)。
a.都属于芳香化合物
b.都能与H2发生加成反应,Ⅳ消耗的H2更多
c.都能使酸性KMnO4溶液褪色
d.都能与FeCl3溶液发生显色反应
(5)满足以下条件的化合物Ⅰ的同分异构体Ⅵ的结构简式为
①遇FeCl3溶液显示紫色
②l mol Ⅵ与浓溴水反应,最多消耗1 mol Br2
③Ⅵ的核磁共振氢谱有五组峰,峰面积之比为1︰1︰2︰2︰6
查看答案和解析>>
科目:高中化学 来源: 题型:
有A、B、C、D、E五种短周期元素,A是地壳中含量最多的元素,B元素有3种同位素B1、B2、B3,B3原子的质量数是B1的3倍,C是非金属性最强的元素,D和C可以形成DC型离子化合物,且离子的电子层结构相同 ,E元素原子的最外层电子数比内层电子总数少6个。下列说法正确的是
,E元素原子的最外层电子数比内层电子总数少6个。下列说法正确的是
A.离子半径:D+>C-
B.EA2是光导纤维的主要成分
C.A和B可以形成原子个数比1∶1的化合物
D. 以上元素中形成的最高价氧化物对应的水化物酸性最强的是C
查看答案和解析>>
科目:高中化学 来源: 题型:
二氧化氯是黄绿色的气体,可用于水体消毒与废水处理。一种制备方法为:
__H2C2O4 +__NaClO3 +__H2SO4 →__Na2SO4+__CO2↑ +__ClO2↑ +__H2O
完成下列填空:
(1)配平上述反应方程式,该反应的还原产物是__________________________。
(2)该反应每产生0.2 mol ClO2,需要消耗草酸晶体(H2C2O4·2H2O)_________g。
(3)上述反应物中属于第三周期的元素的原子半径大小顺序__________________________,
其中原子半径最大的元素最外层电子云形状为___________________________。
(4)二氧化氯具有强氧化性,能漂白有色物质,其漂白原理与__________相同。(写一种)
(5)二氧化氯能净化有毒废水中的氰化钠(NaCN),生成NaCl、CO2和N2,请写出此反应的离子方程式:_______________________________________________。
(6)上述反应产物NaCl中含有 __________键,工业上用电解熔融的氯化钠制备金属钠,氯气在_________(写电极名称)产生。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列离子方程式表达正确的是
A.鸡蛋壳浸泡在盐酸中产生气泡: +2H+
+2H+
 CO2+H2O
CO2+H2O
B.四氧化三铁固体溶解在稀硝酸溶液中:Fe3O4+8H+ 2Fe3++Fe2++4H2O
2Fe3++Fe2++4H2O
C.将氨气通入硫酸溶液中:NH3+H+
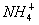
D.向碳酸氢铵溶液中加入足量的NaOH溶液: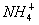 +OH-
+OH- NH3·H2O
NH3·H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
实验表明:将氯水滴加到一张蓝色石蕊试纸上,试纸上会出现如图所示的半径慢慢扩大的内外两个圆环,且两环颜色不同,下列有关说法中不正确的是
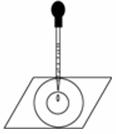
A.此实验表明氯水具有酸性、漂白性
B.内环呈白色外环呈红色或浅红色
C.内外环上颜色的差异表明此变化过程中,中和反应比氧化还原反应快
D.氯水中形成次氯酸的反应中还原产物是HClO
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是
A.酸式盐的水溶液一定显酸性 B.酸性氧化物一定是非金属氧化物
C.丁达尔效应是溶液和胶体的本质区别 D.HClO是弱酸,但NaClO是强电解质
查看答案和解析>>
科目:高中化学 来源: 题型:
下列离子或分子在溶液中能大量共存是
A.K+、CH3COOH、Br-、SiO32- B.K+、Na+、Cl-、CO32-
C.Na+、Al3+、NH3·H2O、MnO4- D.H+、Fe2+、SO42-、NO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
将1 mol SO2和1 mol O2通入容积固定的密闭容器中,在一定条件下反应达到平衡,平衡时SO3的物质的量为0.3 mol 。此时若移走0.5 mol SO2和0.5 mol O2,则反应达到新平衡时SO3的物质的量( )。
A.为0.3 mol B.为0.15 mol
C.小于0.15 mol D.大于0.15 mol且小于0.3 mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com