
| 14 |
| 6 |
| 14 |
| 7 |
| 16 |
| 8 |
| 35 |
| 17 |
| 235 |
| 92 |
| 238 |
| 92 |
| 235 |
| 92 |
| 238 |
| 92 |
| 235 |
| 92 |
| 238 |
| 92 |
| 14 |
| 6 |
| 14 |
| 7 |
| 14 |
| 6 |
| 14 |
| 7 |
| 14 |
| 6 |
| 16 |
| 8 |
| 14 |
| 6 |
| 16 |
| 8 |


科目:高中化学 来源: 题型:
| A、在含2mol Si-O键的二氧化硅晶体中,氧原子的数目为4NA |
| B、30g二氧化硅晶体中含有0.5NA个二氧化硅分子 |
| C、金刚石晶体中,碳原子数与C-C键数之比为1:2 |
| D、晶体硅、晶体氖均是由相应原子直接构成的原子晶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:

| n(CO2) |
| n(H2) |
| 设备编号 | c(CO2) /mol?L-1 | c(H2) /mol?L-1 | c(CH3OCH3) /mol?L-1 | c(H2O) /mol?L-1 | v(正)和v(逆)比较 |
| Ⅰ | 1.0×10-2 | 1.0×10-2 | 1.0×10-4 | 1.0×10-4 | v(正)=v(逆) |
| Ⅱ | 2.0×10-2 | 1.0×10-2 | 1.0×10-4 | 2.0×10-4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| ||
| ||
| 太阳光 |
| 高温 |



查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 用如图所示装置进行中和热测定实验,请回答下列问题:
用如图所示装置进行中和热测定实验,请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
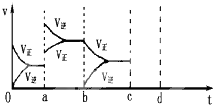 如图表示在密闭容器中反应:CO2(g)+C(s)?2CO(g)△H>0达到平衡时,由于条件改变而引起反应速度和化学平衡的变化情况,ab过程中改变的条件可能是
如图表示在密闭容器中反应:CO2(g)+C(s)?2CO(g)△H>0达到平衡时,由于条件改变而引起反应速度和化学平衡的变化情况,ab过程中改变的条件可能是查看答案和解析>>
科目:高中化学 来源: 题型:
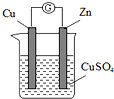 某实验兴趣小组按如图装置实验后,所记录内容合理的是( )
某实验兴趣小组按如图装置实验后,所记录内容合理的是( )| 实验 记录 | ①Cu为正极,Zn为负极; ②Zn质量减少,Cu质量不变; ③SO42- 向Cu极移动; ④电子流方向是:由Zn经导线流入Cu片; ⑤Zn电极发生还原反应; ⑥正极反应式:Cu2++2e-═Cu |
| A、①④⑥ | B、②③④ |
| C、①②⑤ | D、③⑤⑥ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com