
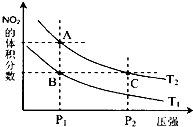
 对反应N2O4(g)?2NO2(g)△H>0,在温度分别为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示,下列说法正确的是bc.
对反应N2O4(g)?2NO2(g)△H>0,在温度分别为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示,下列说法正确的是bc.分析 N2O4(g)═2NO2(g)△H=+57kJ•mol-1,该反应为吸热反应,升高温度,化学平衡正向移动,NO2的体积分数增大;增大压强,化学平衡逆向移动,NO2的体积分数减小,结合图象来分析解答.
a、B、C两点相比,压强越大,反应速率越快;
b、压强相同,升高温度,化学平衡正向移动,NO2的体积分数增大,A点NO2的体积分数大;
c、增大压强平衡向逆反应进行,向逆反应进行是减小由于压强增大导致浓度增大趋势,但到达平衡仍比原平衡浓度大;
D、A、C点是等温线上的两点,温度不变平衡常数不变.
解答 解:a.由图象可知,B、C两点中,C的压强大,则B、C两点的反应速率:B<C,故A错误;
b.升高温度,化学平衡正向移动,NO2的体积分数增大,由图象可知,A点NO2的体积分数大,则T1<T2,由状态B到状态A,可以用加热的方法,故b正确;
c.由图象可知,A、C两点都在等温线上,C的压强大,与A相比C点平衡向逆反应进行,向逆反应进行是由于减小体积增大压强,平衡移动的结果降低NO2浓度增大趋势,但到达平衡仍比原平衡浓度大,平衡时NO2浓度比A的浓度高,NO2为红棕色气体,则A、C两点气体的颜色:A浅,C深,故c正确;
d.由图象可知,A、C两点都在等温线上,稳定相同则AC点的平衡常数相同,A=C,故d错误;
故选bc.
点评 本题考查化学平衡的图象,明确外界条件对化学平衡的影响及图象中纵横坐标的含义、“定一议二”“先拐先平”原则即可解答,题目难度中等.注意c选项为易错点,改变压强的本质为体积变化.


 培优好卷单元加期末卷系列答案
培优好卷单元加期末卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 硅是制造太阳能电池的常用材料 | |
| B. | 四氧化三铁俗称铁红,可用于作油漆、红色涂料 | |
| C. | Na2O2可用作呼吸面具中的供氧剂 | |
| D. | 二氧化硅是制造光导纤维的材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②④⑤⑥ | B. | ④⑤⑥ | C. | ②④⑤ | D. | ②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 为处理氯甲烷生产企业的副产物CCl4,以减少其对臭氧层的破坏.化学家研究在催化条件下,通过反应CCl4+H2?CHCl3+HCl△H<O,使CCl4转化为重要的化工原料氯仿(CHCl3).已知CCl4的沸点为77℃,CHCl3的沸点为61.2℃.在密闭容器中,该反应达到平衡后,测得如下数据.
为处理氯甲烷生产企业的副产物CCl4,以减少其对臭氧层的破坏.化学家研究在催化条件下,通过反应CCl4+H2?CHCl3+HCl△H<O,使CCl4转化为重要的化工原料氯仿(CHCl3).已知CCl4的沸点为77℃,CHCl3的沸点为61.2℃.在密闭容器中,该反应达到平衡后,测得如下数据.| 实验序号 | 温度℃ | 初始CCl4浓度(mol•L-1) | 初始H2浓度(mol•L-1) | CCl4的转化率 |
| 1 | 110 | 1 | 1 | 50% |
| 2 | 100 | 1 | 1 | x |
| 3 | 110 | 0.8 | y | 60% |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
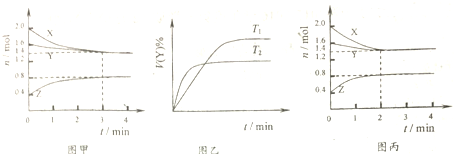
| A. | T1℃时,容器中发生的反应可表示为:3X(g)+Y(g)?2Z(g),且正反应放热 | |
| B. | T1℃时,反应进行的前3min内,用X表示的反应速率v(X)=0.2mol•(L•min)-1 | |
| C. | T1℃时,3min达到平衡后,向容器中再加入2.0mol X、1.6mol Y、0.4mol Z,反应达到新平衡时:0.7mol•L-1<c(Y)<1.4mol•L-1 | |
| D. | 若改变反应条件,使反应进程如图丙所示,则改变的条件是使用催化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③④ | B. | ③④ | C. | ②③④ | D. | ②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物理性质 | 制备原理 | 化学性质 |
| 黄色油状液体 熔点为-40℃,沸点为71℃ 不溶于冷水,易溶于有机溶剂 密度为1.65g/mL | Cl2与NH4Cl水溶液在低温下反应 | 95℃爆炸,热水中发生水解 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 不反应 | B. | 烧杯内溶液颜色逐渐变红 | ||
| C. | 金属钠沉入烧杯底部,并产生气泡 | D. | 金属钠浮于液面上,四处游动 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com