
科目:高中化学 来源: 题型:解答题
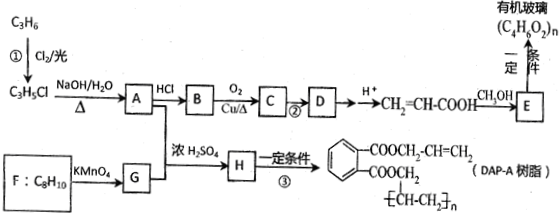
 ;
;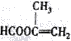 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 阳离子 | Na+ H+ Ba2+ |
| 阴离子 | OH- CO32- SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Y、Z两元素形成的简单阴离子的还原性Z>Y | |
| B. | 原子半径大小的顺序为Z>X>Y>W | |
| C. | X与W形成的化合物W2X2中含有离子键和共价键 | |
| D. | Y、Z两种元素最高价氧化物的水化物的酸性Z>Y |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
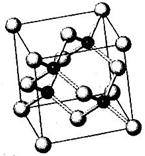 N、P、As、Ga、Cr等元素化合物种类繁多,具有重要的研究价值和应用价值.请回答下列问题:
N、P、As、Ga、Cr等元素化合物种类繁多,具有重要的研究价值和应用价值.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 喷泉是一种常见的自然现象,其产生原因通常是装置内外存在压强差.
喷泉是一种常见的自然现象,其产生原因通常是装置内外存在压强差.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
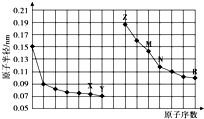
| A. | 最高价氧化物对应水化物的碱性:Z<M | |
| B. | Y、R两种元素气态氢化物的沸点:Y<R | |
| C. | X、N两种元素组成的化合物不与任何酸反应 | |
| D. | 简单离子的半径:Z<X<R |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
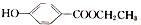 )是一种常用的食品添加剂,合成路线如下:
)是一种常用的食品添加剂,合成路线如下: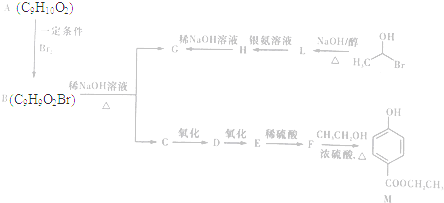
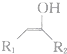 $\stackrel{不稳定、自动转化}{→}$
$\stackrel{不稳定、自动转化}{→}$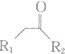 (R1、R2为H或烃基)
(R1、R2为H或烃基) 与稀氢氧化钠溶液不反应
与稀氢氧化钠溶液不反应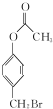 +3NaOH$\stackrel{△}{→}$
+3NaOH$\stackrel{△}{→}$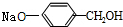 +CH3COONa+H2O+NaBr;
+CH3COONa+H2O+NaBr;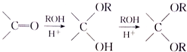 由乙烯、甲醇为有机原料制备化合物
由乙烯、甲醇为有机原料制备化合物 的合成路线流程图(无机试剂任选)如下:
的合成路线流程图(无机试剂任选)如下: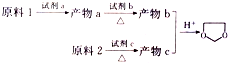
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com