
【题目】I.计算下列溶液的pH值(25 ℃),(请写出计算过程)将20mL0.01 mol·L-1 KOH溶液与30mL0.005mol·L-1H2SO4溶液混合并加水至100ml.
(1)求KOH溶液的pH值_______________;
(2)求H2SO4溶液的pH值_______________;
(3)求混合液的pH值_______________。
II.将10体积的某强酸溶液与1体积的某强碱溶液混合后溶液呈中性,则混合之前,该强酸的pH(酸)与强碱的pH(碱)之间应满足的关系__________。
【答案】pH=12 pH=1 pH=3 pH(酸)+ pH(碱)=15
【解析】
根据pH=-lgc(H+)进行计算,利用c(H+)c(OH-)=Kw=10-14分析。
I. (1) 0.01 mol·L-1 KOH溶液中氢氧根离子浓度为0.01 mol·L-1,则根据c(H+)c(OH-)=Kw=10-14分析,氢离子浓度为10-12 mol·L-1,则pH=12;
(2) 0.005mol·L-1H2SO4溶液中氢离子浓度为0.01 mol·L-1,根据pH=-lgc(H+)分析,则pH=1;
(3).氢氧化钾的物质的量为0.01 mol·L-1×0.02L=0.0002mol,硫酸中氢离子物质的量为0.01 mol·L-1×0.03L=0.0003mol,二者反应后氢离子物质的量0.0003mol-0.0002mol=0.0001 mol,浓度为![]() =0.001 mol·L-1,则有pH=3;
=0.001 mol·L-1,则有pH=3;
II. 将10体积的某强酸溶液与1体积的某强碱溶液混合后溶液呈中性,假设强酸的pH为a,则氢离子浓度为10-amol/L,强碱的pH为b,则氢氧根离子浓度为10-14+bmol/L,则有10×10-a =10-14+b×1 ,则有-a+1=14+b,则有a+b=15,pH(酸)+ pH(碱)=15。


 阶梯计算系列答案
阶梯计算系列答案科目:高中化学 来源: 题型:
【题目】Ⅰ.某温度下,纯水中的c(H+)=2.0×10-7mol·L-1,则此时溶液的c(OH-)=____ mol·L-1,这种水显____(填“酸”“碱”或“中”)性;若温度不变,滴入稀盐酸使c(H+)=5.0×10-6 mol·L-1,则c(OH-)=__ mol·L-1。
Ⅱ. (1)在2mL 0.1mol·L-1的NaCl溶液中,加入2mL 0.1mol·L-1的AgNO3溶液,可观察到____,此反应的离子方程式为______________。 将此混合液过滤,滤渣加入2mL 0.1mol·L-1的KI溶液,搅拌,可观察到_______________, 反应的离子方程式为____________。
(2)下列说法不正确的是___。
A.用稀盐酸洗涤AgCl沉淀比用水洗涤损耗AgCl小
B.所有物质的溶解都是吸热的
C. 沉淀反应中常加过量的沉淀剂,其目的是使沉淀完全
D.除去溶液中的Mg2+,用OH-沉淀Mg2+比![]() 用效果好,说明 Mg(OH)2的溶解度比MgCO3大
用效果好,说明 Mg(OH)2的溶解度比MgCO3大
Ⅲ. 25 ℃,两种常见酸的电离常数如下表所示。
Ka1 | Ka2 | |
H2SO3 | 1.3×10-2 | 6.3×10-8 |
H2CO3 | 4.2×10-7 | 5.6×10-11 |
(1)![]() 的电离常数表达式 K =_____________。
的电离常数表达式 K =_____________。
(2)H2SO3溶液和NaHCO3溶液反应的主要离子方程式为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁镍可充电电池以KOH溶液为电解液,放电时的总反应为Fe+Ni2O3+3H2O=Fe(OH)2+2Ni(OH)2,下列有关该电池的说法正确的是
A.放电时,正极反应式为Fe-2e-+2OH-=Fe(OH)2
B.放电时,K+向Fe电极迁移
C.充电时,阴极反应式为2Ni(OH)2-2e-+2OH-=Ni2O3+3H2O
D.充电时,阳极附近溶液的pH减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种电解法制备高纯铬和硫酸的简单装置如图所示。下列说法正确的是
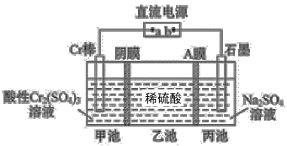
A.b为直流电源的负极
B.阴极反应式为2H++2e-=H2↑
C.工作时,乙池中溶液的pH减小
D.若有1mol离子通过A膜,理论上阳极生成5.6mL气体
查看答案和解析>>
科目:高中化学 来源: 题型:
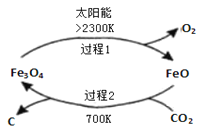
【题目】![]() 是燃烧和代谢的最终产物,也是造成温室效应的废气,但
是燃烧和代谢的最终产物,也是造成温室效应的废气,但![]() 作为一种资源,开发和利用的前景十分诱人.
作为一种资源,开发和利用的前景十分诱人.
I、利用太阳能,以![]() 为原料制取炭黑的流程如图所示.过程2的化学方程式为______.
为原料制取炭黑的流程如图所示.过程2的化学方程式为______.
II、近年科学家提出“绿色自由”构想.把含有大量![]() 的空气吹入
的空气吹入![]() 溶液中,再把
溶液中,再把![]() 从溶液中提取出来,并使之与
从溶液中提取出来,并使之与![]() 反应生成.其工艺流程如图所示:
反应生成.其工艺流程如图所示:

![]() 由吸收池导入分解池中的主要物质的化学式是______.
由吸收池导入分解池中的主要物质的化学式是______.
![]() 上述流程中______
上述流程中______![]() 填化学式
填化学式![]() 可循环使用,体现了该流程的“绿色”.
可循环使用,体现了该流程的“绿色”.
![]() 不同温度下,在1L恒容密闭容器中充入2mol
不同温度下,在1L恒容密闭容器中充入2mol![]() 和5mol
和5mol![]() ,相同时间内测得
,相同时间内测得![]() 的转化率随温度变化如图所示:
的转化率随温度变化如图所示:

![]() 合成塔中发生的化学反应方程式为______.
合成塔中发生的化学反应方程式为______.
![]() 时a点(正)______ (逆)(填“
时a点(正)______ (逆)(填“![]() ”,“
”,“![]() ”,“
”,“![]() ”);
”);
![]() 计算温度为
计算温度为![]() 时b的平衡常数为______.
时b的平衡常数为______.
![]() 为检验吸收池中饱和
为检验吸收池中饱和![]() 溶液是否充足,量取100mL吸收液用
溶液是否充足,量取100mL吸收液用![]() 盐酸滴定,生成的
盐酸滴定,生成的![]() 标准状况下
标准状况下![]() 随
随![]() 盐酸
盐酸![]() 变化关系如图所示:
变化关系如图所示:

则该100mL吸收液还可吸收标准状况下______![]() .
.
Ⅲ![]() 以稀硫酸为电解质溶液,惰性材料为电极,利用太阳能将
以稀硫酸为电解质溶液,惰性材料为电极,利用太阳能将![]() 转化为低碳烯烃,工作原理如图所示.
转化为低碳烯烃,工作原理如图所示.

![]() 的移动方向是______
的移动方向是______![]() 填从左至右或从右至左
填从左至右或从右至左![]()
![]() 产生乙烯的电极反应式为______.
产生乙烯的电极反应式为______.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 时,向
时,向![]() 恒容密闭容器中充入
恒容密闭容器中充入![]() ,反应
,反应![]() 经过一段时间后达到平衡,反应过程中测定的部分数据如图所示。下列说法正确的是
经过一段时间后达到平衡,反应过程中测定的部分数据如图所示。下列说法正确的是![]()
![]()

A.反应在前50s的平均速率![]()
![]()
B.相同温度下,起始时向容器中充入![]() mol
mol![]() 和
和![]() mol
mol![]() ,达到平衡时,
,达到平衡时,![]() 的转化率小于
的转化率小于![]()
C.![]() 时,该反应的化学平衡常数
时,该反应的化学平衡常数![]()
D.相同温度下,起始时向容器中充入![]() mol
mol![]() 、
、![]() mol
mol![]() 和
和![]() mol
mol![]() ,反应达到平衡前
,反应达到平衡前![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】重铬酸钾常用作有机合成的氧化剂和催化剂等。由含铬废液(主要含Cr3+、Fe3+、K+、SO42-等)制备K2Cr2O7的流程如下图所示。
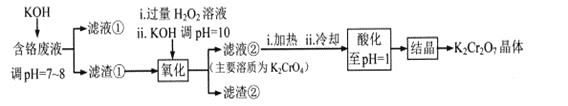
已知:I 在酸性条件下,H2O2能将Cr2O72-还原为Cr3+
II相关金属离子形成氢氧化物沉淀的pH范围如下:

回答下列问题:
(1)滤渣②的主要成分为___________(填化学式)。
(2)写出“氧化”步骤中反应的化学方程式_______________。
(3)“加热”操作的目的是__________________。
(4)“酸化”过程中发生反应2CrO42-+2H+![]() Cr2O72-+H2O (K=4×1014 L3.mol3)已知,“酸化”后溶液中c(Cr2O72-)=1.6×10-3mol/L则溶液中c(CrO42-)=_________
Cr2O72-+H2O (K=4×1014 L3.mol3)已知,“酸化”后溶液中c(Cr2O72-)=1.6×10-3mol/L则溶液中c(CrO42-)=_________
(5)“结晶”后得到K2Cr2O7(M=294g.mol-1)产品0.5000 g,将其溶解后用稀H2SO4酸化,再用浓度为1.0000 mol.L-1 (NH4)2Fe(SO4)2标准溶液滴定,滴定终点消耗标准溶液的体积为 9.00 mL,则产品的纯度为_____________。[滴定反应为:K2Cr2O7+6(NH4)2Fe(SO4)2+7H2SO4 =K2SO4 +Cr2(SO4)3 +6(NH4)2SO4+3Fe2(SO4)3+7H2O]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是![]()
![]()
A.分子式为![]() 的有机物,结构中有2个甲基的同分异构体有4种
的有机物,结构中有2个甲基的同分异构体有4种
B.如图可表示为四氯化碳的球棍模型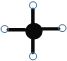
C.三氯甲烷只有一种结构,不存在同分异构体,证明甲烷是正四面体结构
D.醋酸的分子式可表示为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】N2H4是一种高效清洁的火箭燃料。8gN2H4(g)完全燃烧生成氮气和气态水时,放出133.5kJ热量。则下列热化学方程式中正确的是( )
A.![]() N2H4(g)+
N2H4(g)+![]() O2(g)=
O2(g)=![]() N2(g)+H2O(g) ΔH=+267kJ·mol-1
N2(g)+H2O(g) ΔH=+267kJ·mol-1
B.N2H4(g)+O2(g)=N2(g)+2H2O(g) ΔH=-534kJ·mol-1
C.N2H4(g)+O2(g)=N2(g)+2H2O(g) ΔH=+534kJ·mol-1
D.N2H4(g)+O2(g)=N2(g)+2H2O(l) ΔH=-133.5kJ·mol-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com