
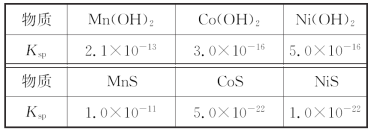
【题目】锰是冶炼工业中常用的添加剂。以碳酸锰矿(主要成分为MnCO3,还含有铁、镍、钴等碳酸盐杂质)为原料生产金属锰的工艺流程如下,已知25℃,部分物质的溶度积常数如下:
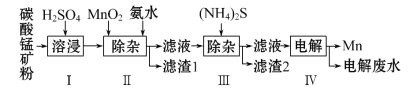
(1)步骤Ⅰ中,MnCO3与硫酸反应的化学方程式是______________。
(2)步骤Ⅱ中,MnO2在酸性条件下将Fe2+氧化为Fe3+,反应的离子方程式是__________________,加氨水调节溶液的pH为5.0~6.0,以除去Fe3+。
(3)步骤Ⅲ中,滤渣2的主要成分是________。
(4)步骤Ⅳ中,在________(填“阴”或“阳”)极析出Mn,电极反应为___________________。
【答案】
(1)MnCO3+H2SO4=MnSO4+CO2↑+H2O
(2)MnO2+2Fe2++4H+=Mn2++2Fe3++2H2O
(3)CoS和NiS
(4)阴;Mn2++2e-=Mn
【解析】
试题分析:(1)碳酸锰与硫酸反应生成硫酸锰、二氧化碳和水,化学方程式为MnCO3+H2SO4=MnSO4+CO2↑+H2O,故答案为:MnCO3+H2SO4=MnSO4+CO2↑+H2O;
(2)MnO2在酸性条件下可将Fe2+氧化为Fe3+,MnO2被还原成Mn2+,发生反应的离子方程式为MnO2+2Fe2++4H+=Mn2++2Fe3++2H2O,故答案为:MnO2+2Fe2++4H+=Mn2++2Fe3++2H2O;
(3)步骤Ⅲ中加入(NH4)2S,除掉的是Co2+和Ni2+,所以滤渣2的主要成分是CoS和NiS,故答案为:CoS和NiS;
(4)Mn2+在阴极发生还原反应生成Mn,电极反应为Mn2++2e-=Mn,故答案为:阴;Mn2++2e-=Mn。


 文敬图书课时先锋系列答案
文敬图书课时先锋系列答案科目:高中化学 来源: 题型:
【题目】已知红磷通常要比白磷稳定,下列两个反应:
①P4(白磷,s)+5O2(g)=2P2O5(s) △H1
②4P(红磷,s)+5O2(g)=2P2O5(s) △H2
则△H1和△H2的关系是
A.△H1=△H2 B.△H1>△H2 C.△H1<△H2 D.无法确定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】糖类、油脂和蛋白质是维持人体生命活动所必须的三大营养物质。以下叙述不正确的是
A.淀粉水解的最终产物是葡萄糖
B.葡萄糖与新制氢氧化铜悬浊液共沸有砖红色沉淀产生
C.油脂在碱性条件下水解可制肥皂
D.蛋白质遇硫酸铜溶液后产生的沉淀能重新溶于水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应原理符合工业冶炼金属镁的是
A.2Na+MgCl2=2NaCl+Mg
B.MgCl2(熔化)![]() Mg+Cl2
Mg+Cl2
C.2MgO![]() 2Mg+O2
2Mg+O2
D.MgO+C![]() MgO+C
MgO+C
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乌洛托品在合成、医药、染料等工业中有广泛用途,其结构式如图所示。将甲醛水溶液与氨水混合蒸发可制得乌洛托品。若原料完全反应生成乌洛托品,则甲醛与氨的物质的量之比为( )
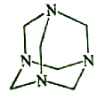
A.1:1 B.2:3 C.3:2 D.2:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能源是现代社会发展的支柱之一。
(1)化学反应中的能量变化,通常主要表现为热量的变化。
①下列反应中,属于放热反应的是___________(填序号)。
a.Ba(OH)2·8H2O与NH4Cl混合搅拌
b.高温煅烧石灰石
c.铝与盐酸反应
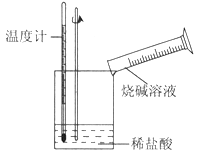
②某同学进行如图所示实验,测量稀盐酸与烧碱溶液中和反应的能量变化。实验表明:反应温度升高,由此判断该反应是__________(填“吸热”或“放热”)反应,其离子方程式是_________________________。
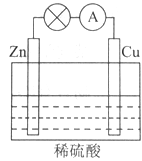
(2)电能是现代社会应用最广泛的能源之一。如图所示的原电池装置中,其负极是____________________,正极上能够观察到的现象是____________________________,正极的电极反应式是_________________________。原电池工作一段时间后,若消耗锌6.5g,则放出标准状况下气体__________L,电路中通过的电子数为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】密闭容器中A与B反应生成C,其反应速率分别用v (A)、v (B)、v (C)表示。已知v (A)、v (B)、v (C)之间有以下关系2 v (B) = 3 v (A)、3 v (C) = 2 v (B)。则此反应可表示为
A.2A + 3B = 2C B.A + 3B = 2C C.3A + B = 2C D.A + B = C
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com