
| A. | 浓硫酸 | B. | 浓盐酸 | C. | 硫酸铜溶液 | D. | 氯化铁溶液 |
分析 A、浓硫酸有强氧化性,能把铁的表面氧化成致密的氧化物薄膜而钝化;
B、浓盐酸是弱氧化性的酸,能和铁反应生成氢气;
C、铁和硫酸铜能发生置换反应,置换出金属铜;
D、氯化铁能和铁发生归中反应.
解答 解:A、浓硫酸有强氧化性,能把铁的表面氧化成致密的氧化物薄膜,这层薄膜阻止了酸与内层金属的进一步的反应,故A正确;
B、浓盐酸是弱氧化性的酸,能和铁反应生成氢气,故B错误;
C、铁和硫酸铜能发生置换反应,置换出金属铜,故C错误;
D、氯化铁能和铁发生归中反应生成氯化亚铁,故D错误;
故选A.
点评 本题考查了铁的化学性质,铁、铝都能和浓硫酸、浓硝酸在常温下发生钝化现象,所以可用铁、铝制容器盛放浓硫酸、浓硝酸.


科目:高中化学 来源: 题型:选择题
| A. | 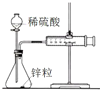 图中测定锌粒与1 mol/L稀硫酸反应速率,只需测定量筒中收集氢气的体积 | |
| B. |  装置中进行50 mL 0.50 mol/L盐酸与50 mL 0.55 mol/L NaOH溶液测定中和热,使温度计温度升高的热量就是中和反应生成1 mol水的热量 | |
| C. | 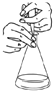 酸碱中和滴定中,可以在滴定过程中用少量水冲洗锥形瓶内壁以减小实验误差 | |
| D. |  滴定管中读数为26.50mL |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在氮化铝的合成反应中,N2是还原剂,Al2O3氧化剂 | |
| B. | 氮化铝是铝合金中的一种 | |
| C. | 上述反应中每生成2molAlN,N失去6mol电子 | |
| D. | 氮化铝中氮元素的化合价为-3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 弱碱性溶液中:Na+、K+、Cl-、HCO3- | |
| B. | 无色透明的酸性溶液中:Al3+、NH4+、Cl?、HCO3? | |
| C. | pH=1的溶液中:ClO-、SO42-、Fe2+、K+ | |
| D. | 由水电离的c(OH-)=10-14mol•L-1的溶液中:CH3 COO-、SO42-、Na+、NH4+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在pH=1的无色溶液中:SO42-、Cu2+、Na+、Cl- | |
| B. | 常温下由水电离出的c(H+)=1×10-12mol/L的溶液中:K+、Na+、Cl-、HCO3- | |
| C. | 有Fe3+存在的溶液中:CO32-、NH4+、SO42-、Cl- | |
| D. | 在能使石蕊试纸变蓝色的溶液中:Na+、K+、S2-、CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2H2(g)+O2(g)═2H2O(g)△H=-480.4kJ/mol | B. | H2(g)+$\frac{1}{2}$O2(g)═H2O(l)△H=-240.2kJ/mol | ||
| C. | 2H2(g)+O2(g)═2H2O(g)△H=+480.4kJ/mol | D. | H2(g)+$\frac{1}{2}$O2(g)═H2O(l)△H=-480.4kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 水玻璃用作木材防火剂 | |
| B. | 高纯度的硅是制造光导纤维的材料 | |
| C. | 可用氢氟酸刻蚀玻璃 | |
| D. | 氢氧化铝、小苏打可用于治疗胃酸过多症 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A.含有Fe3+的溶液: | Na+、SCN-、Cl-、I- |
| B.含有大量NO3-的溶液: | H+、Fe2+、Cl-、SO42- |
| C.常温下,pH=12的溶液: | K+、Cl-、SO32-、AlO2- |
| D.c(H+)=0.1 mol•L-1的溶液: | Na+、NH4+、SO42-、S2O32- |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 质谱仪 | B. | 红外光谱仪 | C. | 元素分析仪 | D. | 核磁共振仪 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com