
【题目】氧化还原反应是一类重要的反应,请按要求完成下列题目。
(1)对反应NH3+O2——NO+H2O(未配平)作分析,该反应中,________是还原剂,________是氧化剂,________是氧化产物,被还原的物质是________。
(2)在一定条件下,反应2NH3+3CuO![]() 3Cu+N2+3H2O能顺利进行,对此反应的分析合理的是_______(填序号)。
3Cu+N2+3H2O能顺利进行,对此反应的分析合理的是_______(填序号)。
A.该反应是置换反应
B.反应中NH3被氧化为N2
C.在反应中体现了金属铜的还原性
D.在反应中每生成1 mol H2O转移1 mol电子
(3)在反应H2SO3+2H2S==3H2O+3S↓中被氧化的元素与被还原的元素的质量比______。
【答案】NH3 O2 NO O2 B 2:1
【解析】
(1)还原剂是含有化合价升高元素的反应物,氧化剂是含有化合价降低元素的反应物,氧化产物是含化合价升高元素的生成物,被还原的物质是含化合价降低元素的反应物。
(2)A.该反应中没有单质参加反应,不是置换反应;
B.反应中NH3中所含N元素化合价升高;
C.在反应中金属铜的价态降低;
D.在反应中每生成1 mol H2O转移2 mol电子。
(3)在反应H2SO3+2H2S==3H2O+3S↓中被氧化的元素与被还原的元素都是S,由化学计量数关系可确定质量关系。
(1)该反应中,NH3中N元素由-3价升高到0价,NH3是还原剂,O2中O元素由0价降到-2价,O2是氧化剂,NO中N元素化合价升高,NO是氧化产物,被还原的物质是O2。答案为:NH3;O2;NO;O2;
(2)A.该反应中没有单质参加反应,不是置换反应,A不合理;
B.反应中NH3中所含N元素化合价升高,NH3被氧化为N2,B合理;
C.在反应中金属铜的价态降低,体现了CuO的氧化性,C不合理;
D.在反应中3H2O——6e-,则每生成1 mol H2O转移2 mol电子,D不合理;
故选B。答案为:B;
(3)在反应H2SO3+2H2S==3H2O+3S↓中,H2S中的S被氧化,H2SO3中的S被还原,被氧化的元素与被还原的元素的质量比2:1。答案为:2:1。


 培优口算题卡系列答案
培优口算题卡系列答案 开心口算题卡系列答案
开心口算题卡系列答案 口算题卡河北少年儿童出版社系列答案
口算题卡河北少年儿童出版社系列答案科目:高中化学 来源: 题型:
【题目】氯仿(CHCl3)可用作麻醉剂,但常因保存不慎,而被空气中的氧气氧化,生成剧毒的光气(COCl2),发生反应的化学方程式为2CHCl3+O2![]() 2HCl+2COCl2,为防止发生事故,在使用前要检验氯仿是否变质,应选用的试剂是( )
2HCl+2COCl2,为防止发生事故,在使用前要检验氯仿是否变质,应选用的试剂是( )
A. 氢氧化钠溶液 B. 硝酸银溶液 C. 溴水 D. 淀粉碘化钾试剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生用0.2000mol·L-1的标准NaOH溶液滴定未知浓度的盐酸,其操作如下:
①用蒸馏水洗涤碱式滴定管,并立即注入NaOH溶液至“0”刻度线以上;
②固定好滴定管并使滴定管尖嘴处充满液体;
③调节液面至“0”或“0”刻度线以下,并记下读数;
④移取20.00mL待测液注入洁净的还存有少量蒸馏水的锥形瓶中,并加入3滴酚酞溶液;
⑤用标准液滴定至终点,记下滴定管液面读数。
请回答下列问题:
(1)以上步骤有错误的是___(填编号)。若测定结果偏高其原因可能是__(填字母)。
A.配制标准溶液的固体NaOH中混有Na2O杂质
B.滴定终点读数时,俯视滴定管的刻度,其他操作正确
C.盛装待测液的锥形瓶用蒸馏水洗过后再用待测液润洗
D.滴定到终点读数时,发现滴定管尖嘴处悬挂一滴溶液
(2)判断滴定终点的现象是___。
(3)如图是某次滴定时滴定管中的液面,其读数为___mL。
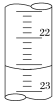
(4)根据下列数据,请计算待测盐酸的浓度:___molL-1。
滴定次数 | 待测体积(mL) | 标准NaOH溶液体积(mL) | |
滴定前读数 | 滴定后读数 | ||
第一次 | 20.00 | 0.40 | 20.40 |
第二次 | 20.00 | 2.00 | 24.10 |
第三次 | 20.00 | 4.00 | 24.00 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素周期律(表)是认识元素化合物性质的重要理论。
(1)某学习小组研究了金属锂、钠、镁的性质后发现:
ⅰ.锂、镁和水反应均较为微弱,钠和水反应较为剧烈
ⅱ.锂和镁的氢氧化物均为中等强度的碱
ⅲ.锂、镁在空气中燃烧均生成氧化物,而钠在空气中燃烧生成过氧化物
根据以上事实,可知锂、钠、镁三种元素的金属性强弱关系是___________________(用“>”“=”或“<”)。
(2)锶(38Sr)元素广泛存在于矿泉水中,是一种人体必需的微量元素,在元素周期表中与20Ca和56Ba同属于第ⅡA族。
①碱性:Sr(OH)2_____ Ba (OH)2(填“>”或“<”)。
②用原子结构的观点解释锶的化学性质与钡差异的原因:______________________________
(3)硒(Se)的部分信息如图,且知34Se、35Br位于同一周期。
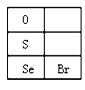
①Se在元素周期表中的位置是_______________。
②H2Se的电子式是______________。
③Cl、Se、Br的非金属性强弱的顺序是__________________;能证明上述强弱关系的事实是____________________________(写出一条即可)。
④某同学对SeO2(白色的挥发性固体,易溶于水)的各种不同化学性质进行推测,并用SO2水溶液、H2O2溶液、NaOH溶液、稀H2SO4等试剂进行实验,证明了推测是正确的。完成下表:
编号 | 性质推测 | 化学方程式 |
1 | 氧化性 | SeO2+2SO2+2H2O=Se+2H2SO4 |
2 | ____________ | ______________ |
3 | ___________ | ____________ |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定量的氯气通入50mL浓度为![]() 的氢氧化钠浓溶液中,加热少许时间后溶液中形成NaCl、NaClO、
的氢氧化钠浓溶液中,加热少许时间后溶液中形成NaCl、NaClO、![]() 共存体系。下列判断正确的是
共存体系。下列判断正确的是
A.与NaOH反应的氯气一定为![]() mol
mol
B.![]() :
:![]() 可能为7:3
可能为7:3
C.若反应中转移的电子为n mol,则![]()
D.![]() :
:![]() :
:![]() 可能为11:1:2
可能为11:1:2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向盛有硫酸铜水溶液的试管里加入氨水,首先形成难溶物,继续添加氨水,难溶物溶解得到深蓝色的透明溶液。下列对此现象说法正确的是
A.反应后溶液中不存在任何沉淀,所以反应前后Cu2+的浓度不变
B.沉淀溶解后,生成深蓝色的配合离子![]()
C.![]() 比
比![]() 中的配位键稳定
中的配位键稳定
D.用硝酸铜溶液代替硫酸铜溶液进行实验,不能观察到同样的现象
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图为甲烷晶体的晶胞结构,下列有关说法正确的是( )
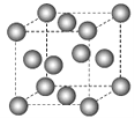
A.甲烷晶胞中的球体只代表一个碳原子
B.晶体中1个![]() 分子有12个紧邻的甲烷分子
分子有12个紧邻的甲烷分子
C.![]() 晶体熔化时需克服共价键
晶体熔化时需克服共价键
D.一个甲烷晶胞中含有8个![]() 分子
分子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物A是分子式为![]() 的五元环状化合物,核磁共振氢谱有四组峰,且其峰面积之比为
的五元环状化合物,核磁共振氢谱有四组峰,且其峰面积之比为![]() ,有如图所示的转化:
,有如图所示的转化:

已知:
![]() 含羰基的化合物均能与格氏试剂发生如下反应:
含羰基的化合物均能与格氏试剂发生如下反应:![]()
![]()
![]()
![]() 两个羟基连在同一碳原子上极不稳定,易脱水:
两个羟基连在同一碳原子上极不稳定,易脱水: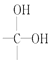 →
→![]() +H2O
+H2O
根据以上信息,回答下列问题:
![]() 写出化合物D中官能团的名称________。
写出化合物D中官能团的名称________。
![]() 写出化合物B、F的结构简式________、________。
写出化合物B、F的结构简式________、________。
![]() 的反应类型是________。
的反应类型是________。
![]() 写出D与
写出D与![]() 反应的化学方程式________________
反应的化学方程式________________![]() 写出
写出![]() 的化学方程式_______________________。
的化学方程式_______________________。
![]() 的属于芳香族化合物的同分异构体有________种,写出符合下列条件的A的一种同分异构体W的结构简式________。
的属于芳香族化合物的同分异构体有________种,写出符合下列条件的A的一种同分异构体W的结构简式________。![]() 不考虑立体异构
不考虑立体异构![]()
![]() 含有两个取代基
含有两个取代基 ![]() 苯环上的一氯代物只有两种
苯环上的一氯代物只有两种 ![]() 能与足量金属钠反应生成
能与足量金属钠反应生成![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA 为阿伏加德罗常数的值。下列说法正确的是
A.2.24L(标准状况下)甲苯在O2中完全燃烧,得到0.7NA个CO2分子
B.1mo1乙酸(忽略挥发损失)与足量的C2H518OH浓硫酸作用下加热,充分反应可生成NA个CH3CO18OC2H5分子
C.14g乙烯和丙烯混合气体中的氢原子数为2NA
D.常温常压下,78g苯含有σ键数为6NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com