
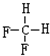 和
和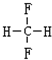
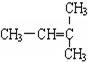 和CH2=CH-CH3
和CH2=CH-CH3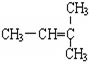 和
和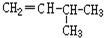
分析 有相同质子数,不同中子数的原子互为同位素;
具有相同分子式而结构不同的化合物互为同分异构体;
结构相似、分子组成相差若干个“CH2”原子团的有机化合物互相称为同系物;
相同元素组成,不同形态的单质互为同素异形体.
解答 解:A.O2和O3都是由氧元素形成的不同单质,故互为同素异形体,
B.126C和136C质子数相同,中子数不同,故互为同位素,
C.CH3CH2CH2CH3和CH3CH(CH3)2分子式相同,但结构不同,故互为同分异构体,
D.CH3CH2CH2CH(C2H5)CH3和CH3CH2CH2CH(CH3)CH2CH3是同一物质,
E.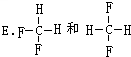 是同一物质,
是同一物质,
F.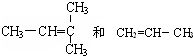 结构相似,分子组成相差2个“CH2”原子团,故互为同系物,
结构相似,分子组成相差2个“CH2”原子团,故互为同系物,
G.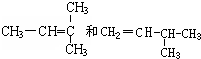 分子式相同,但结构不同,故互为同分异构体,
分子式相同,但结构不同,故互为同分异构体,
互为同位素的是:B,互为同素异形体的是:A,互为同系物的是:F,
互为同分异构体的是CG,为同一物质的是:DE,
故答案为:B;A;F;CG;DE.
点评 本题考查同位素、同素异形体、同分异构体、同系物的概念,难度不大.对于元素、核素、同位素、同素异形体、同分异构体、同系物、同种物质等概念的区别是考试的热点问题.


科目:高中化学 来源: 题型:选择题
| A. | 1 mol-OH中含有10 NA个电子 | |
| B. | 1 L 1 mol•L-1CH3COONa溶液中含有NA个CH3COO- | |
| C. | 28g晶体硅中含有共价键数目为2NA个 | |
| D. | 常温常压下11.2 L甲烷气体含有的分子数为0.5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
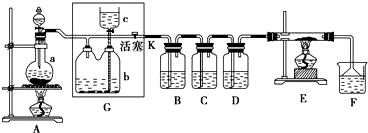
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 A、B、C、D四种元素的核电荷数均小于18,A元素原子核外只有1个电子;B是地壳中含量最多的元素;B、C可形成两种化合物CB和CB2,C的最高正价与最低负价绝对值相等,CB有毒,CB2可用于灭火;D+具有与Ne原子相同的电子层结构.
A、B、C、D四种元素的核电荷数均小于18,A元素原子核外只有1个电子;B是地壳中含量最多的元素;B、C可形成两种化合物CB和CB2,C的最高正价与最低负价绝对值相等,CB有毒,CB2可用于灭火;D+具有与Ne原子相同的电子层结构.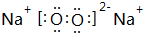 ,CB2的电子式 为
,CB2的电子式 为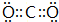 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 绿色食品就是不含任何化学物质的食品 | |
| B. | 燃煤时添加生石灰以减少SO2的排放 | |
| C. | PM2.5是指环境空气中直径小于或等于2.5微米的颗粒物 | |
| D. | pH在5.6~7.0之间的降水通常称为酸雨 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 )具有高度的对称性,Eaton教授在此基础上经七步反应合成了二羧基立方烷,二羧基立方烷的同分异构体数目为( )
)具有高度的对称性,Eaton教授在此基础上经七步反应合成了二羧基立方烷,二羧基立方烷的同分异构体数目为( )| A. | 2 | B. | 3 | C. | 4 | D. | 5 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ;X在UW2中剧烈燃烧生成的黑、白两种固体中化学键类型依次是共价键、离子键.
;X在UW2中剧烈燃烧生成的黑、白两种固体中化学键类型依次是共价键、离子键.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com