
【题目】下列离子方程式正确的是 ( )
A. 向稀HNO3中滴加Na2SO3溶液:SO32-+2H+=SO2↑+H2O
B. 少量SO2通入氢氧化钠溶液中:OH-+SO2=HSO3-
C. 加热可增强纯碱溶液去污能力:CO32-+2H2O![]() H2CO3+2OH-
H2CO3+2OH-
D. 用惰性电极电解CuSO4溶液: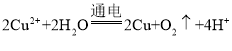
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】某化学课外兴趣小组为探究铜跟浓硫酸的反应情况,设计了如图所示装置进行有关实验:

(1)先关闭活塞a,将6.4g铜片和10mL18mol/L的浓硫酸放在圆底烧瓶中共热至反应完成,发现烧瓶中还有铜片剩余.再打开活塞a,将气球中的氧气缓缓挤入圆底烧瓶,最后铜片完全消失。
①写出上述过程中圆底烧瓶内发生反应的化学方程式:打开活塞a之前______________;打开活塞a之后______________;
②B是用来收集实验中产生的气体的装置,但集气瓶内的导管未画全,请直接在图上把导管补充完整______________;
(2)实际上,在打开活塞a之前硫酸仍有剩余.为定量测定余酸的物质的量,甲、乙两学生进行了如下设计:
①甲学生设计的方案是:先测定铜与浓硫酸反应产生SO2的量,再通过计算确定余酸的物质的量.他测定SO2的方法是将装置A产生的气体缓缓通过装置D,从而测出装置A产生气体的体积(已折算成标准状况下)。你认为甲学生设计的实验方案中D装置中的试剂为______________(填化学式);
②乙学生设计的方案是:将反应后的溶液冷却后全部移入到烧杯中稀释,并按正确操作配制100mL溶液,再取20mL于锥形瓶中,用______________作指示剂,用标准氢氧化钠溶液进行滴定[已知:Cu(OH)2开始沉淀的pH约为5],选择该指示剂的理由为______________;再求出余酸的物质的量,若耗去amol/L氢氧化钠溶液bmL,则原余酸的物质的量为______________mol(用含a、b的表达式来表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有 A、B、C、D、E、F 六种短周期主族元素,其相关性质信息如下:
元素 | 相关信息 |
A | 地壳中含量最多的金属元素 |
B | 原子核外电子数和周期序数相等 |
C | 最外层电子数是次外层电子数的 3 倍 |
D | 最高正价与最低负价代数和为 4,常温下单质为固体 |
E | 在短周期元素中,原子半径最大 |
F | M 层比L 层少 1 个电子 |
请根据上述信息,完成下列问题:
(1)请给出元素 D 在元素周期表中的位置:________。
(2)请将 A、D、E、F 四种元素的简单离子按照离子半径由大到小排序(用离子符号表示):__________。
(3)请给出化合物 BFC 的电子式:______。
(4)用电子式表示 E 与 F 形成化合物 EF 的过程:______。
(5)请将 A、D、F 三种元素的最高价氧化物对应的水化物按照酸性由强到弱排序(用化学式表示):__________。
(6)元素 A 的单质常用于野外焊接钢轨,请写出该反应的化学方程式:________。
(7)单质 A 能溶于 E 的最高价氧化物对应水化物的水溶液,请给出该反应的离子方程式:_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:2CrO42-+2H+Cr2O72-+H2O。25℃时,调节初始浓度为1.0molL-1的Na2CrO4溶液的pH,测定平衡时溶液中c(Cr2O72-)和c(H+),获得如图所示的曲线。下列说法不正确的是( )

A.平衡时,pH越小,c(Cr2O72-)越大
B.A点CrO42-的平衡转化率为50%
C.A点CrO42-转化为Cr2O72-反应的平衡常数K=1014
D.平衡时,若溶液中c(Cr2O72-)=c(CrO42-),则c(H+)>2.0×10-7molL-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】依据事实,回答下列问题。
(1)在 25℃、101 kPa 时,1.0 g C8H18(l,辛烷)燃烧生成CO2(g)和H2O(l),放出48.40kJ的热量,则C8H18(l)的燃烧热为_____kJ/mol
(2)已知N2(g)+2O2(g)=2NO2(g) ΔH=+67.7kJ/mol,N2H4(g)+O2(g)= N2(g)+2H2O (g) ΔH=-534kJ/mol,根据盖斯定律写出肼(N2H4)与 NO2完全反应生成氮气和气态水的热化学方程式____________。
(3)某反应过程中的能量变化如图所示,则该反应是___________反应(填“放热”或“吸热”),判断依据是____________________。

(4)已知:2NH3 (g)+3Cl2(g) =N2 (g) +6HCl(g) ΔH=–462 kJmol-1
N2(g)![]() 2N(g)
2N(g)
Cl2(g)![]() 2Cl(g)
2Cl(g)
则断开1 mol H–N键与断开1 mol H-Cl键所需能量相差约为_____kJ。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】依据如图中氮元素及其化合物的转化关系,回答问题:
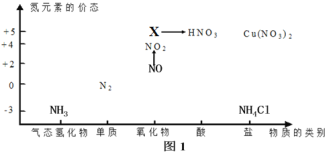
(1)图1中,X的化学式为________________;
(2)回答下列关于NH3的问题:
①实验室常用NH4Cl与Ca(OH)2制取氨气,该反应的化学方程式为:________________;
②下列试剂不能用于干燥NH3的是________________(填字母)。
A.浓硫酸B.碱石灰C.NaOH固体
③氨气是重要的化工原料,可以合成多种物质,写出催化氧化的化学方程式:________________;
(3)回答下列关于NO、NO2的问题:
①汽车排气管上装有催化转化器可减少尾气对环境的污染,发生的反应为:2NO+2CO![]() N2+2CO2该反应中,被氧化的物质是________________(填化学式),若反应中生成1molN2,则转移电子________________mol;
N2+2CO2该反应中,被氧化的物质是________________(填化学式),若反应中生成1molN2,则转移电子________________mol;
②NO→NO2的颜色变化是________________;
(4)工业生产中利用氨水吸收SO2和NO2,原理如图所示:
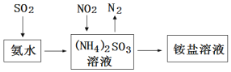
NO2被吸收过程的离子方程式是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是
A.向铁粉中加入足量稀盐酸:Fe+2H+=Fe3++H2↑
B.向FeCl3溶液中加入少量铜粉:Fe3++Cu=Fe2++Cu2+
C.Cu与稀硝酸反应:3Cu+8H++2![]() =3Cu2++2NO↑+4H2O
=3Cu2++2NO↑+4H2O
D.向AlCl3溶液中滴加浓氨水至过量:Al3++4OH-=![]() +2H2O
+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钠、镁、铝的单质及其化合物是中学阶段重点研宄的物成.
(1)按性质分类,Na2O2____________(填“属于”或“不属于”)碱性氧化物。
(2)用离子方程式说明Al(OH)3是两性氢氧化物: ____________________。
(3)某同学用如图所示装置进行实验探究有关钠、镁、铝的化合物的性质(夹持仪器省略)。将液体A遂满加入到固体B中,回答下列问题:
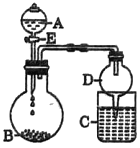
①若A为70%硫酸溶液,B为Na2SO3,C盛有氢硫酸(H2S)饱和溶液,旋开E后,C中发生反应的化学方程式为________________________。
②若A为水,B为Mg3N2,C中盛有AlC13溶液,旋开E,足够长的时间后,C中发生反应的离子方程式为__________________________。
③若A为浓盐酸,B为NaClO3,C中盛有KI-淀粉溶液,旋开E后,C中的现象是________________,继续通气体于C中,足够长的时间后,发现C中溶液的颜色消失,这是因为在溶液中I2能被Cl2氧化为HIO3,写出该反应的化学方程式: _______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA代表阿伏加德罗常数的值,下列说法正确的是( )
A. 100 mL 1 mol·L-1FeCl3溶液中所含Fe3+的数目为0.1NA
B. 常温常压下,11.2 L甲烷和乙烯混合物中含氢原子数目为2NA
C. 密闭容器中,2 mol SO2和1 mol O2催化反应后分子总数为2NA
D. 标准状况下,124 g P4中所含P—P键数目为6NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com