
| 选项 | 实验操作 | 实验目的 |
| A | 溴乙烷在氢氧化钠溶液存在下加热水解后,加入硝酸银溶液 | 可用于检验溴元素的存在 |
| B | 苯中有少量苯酚,加入氢氧化钠溶液后,分液 | 可用于除去苯中的苯酚 |
| C | 乙烷中有少量乙烯,通入酸性KMnO4溶液中 | 可用于除去乙烷中的乙烯 |
| D | 测乙烯与溴水反应前后的pH | 可验证发生的是加成反应还是取代反应 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.在加入硝酸银溶液之前必须加入稀硝酸中和未反应的NaOH;
B.苯和NaOH不反应且分层,苯酚和NaOH生成可溶性的苯酚钠;
C.乙烯和酸性高锰酸钾溶液反应生成二氧化碳,乙烷和酸性高锰酸钾溶液不反应;
D.如果苯和溴发生加成反应时其pH变化不大,如果和溴发生取代反应时生成HBr,溶液酸性较强.
解答 解:A.在加入硝酸银溶液之前必须加入稀硝酸中和未反应的NaOH,否则硝酸银和NaOH反应生成黑色的氧化银而干扰实验,故A错误;
B.苯和NaOH不反应且分层,苯酚和NaOH生成可溶性的苯酚钠,然后采用分液方法分离提纯,故B正确;
C.乙烯和酸性高锰酸钾溶液反应生成二氧化碳,乙烷和酸性高锰酸钾溶液不反应,除去杂质又引进新的杂质,应该用溴水除去乙烷中的乙烯,故C错误;
D.如果苯和溴发生加成反应时其pH变化不大,如果和溴发生取代反应时生成HBr,溶液酸性较强,所以可以根据溶液pH大小确定发生反应类型,故D正确;
故选BD.
点评 本题考查化学实验方案评价,为高频考点,涉及反应类型判断、除杂、元素检验等知识点,侧重考查学生分析判断、实验操作等能力,明确实验原理、物质性质差异性等是解本题关键,注意:除杂时不能引进新的杂质,易错选项是AC.


 应用题作业本系列答案
应用题作业本系列答案科目:高中化学 来源: 题型:实验题
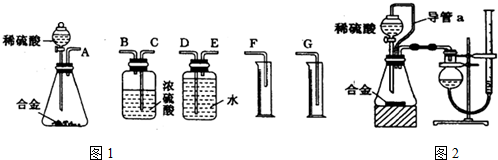
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 单烯烃和环烷烃互为同分异构体 | |
| B. | 分子式相差一个或多个“CH2”的有机物一定互为同系物 | |
| C. | 单烯烃的通式是CnH2n,则二烯烃的通式为CnH2n-2 | |
| D. | n>2时,CnH2n+2的同分异构体比CnH2n的同分异构体多 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 晶体 | NaCl | KCl | CaO |
| 晶格能/(kJ•mol-1) | 786 | 715 | 3 401 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
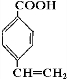 .
.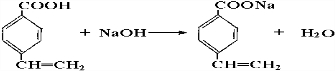 .
.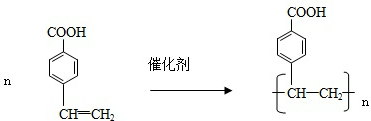 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯常温下是气体,为纯净物;聚乙烯常温下是固体,为混合物 | |
| B. | 可以采用通过溴水洗气的方法以除去乙烷中的乙烯气体 | |
| C. | 乙烯和聚乙烯都能使溴水褪色 | |
| D. | 取等质量的乙烯和聚乙烯完全燃烧后,生成的CO2和H2O的质量分别相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
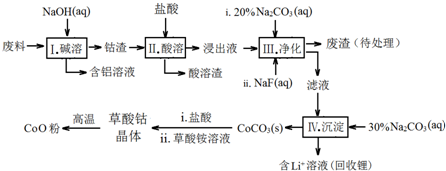
| Fe3+ | Co2+ | Co3+ | Al3+ | |
| pH(开始沉淀) | 1.9 | 7.15 | -0.23 | 3.4 |
| pH(完全沉淀) | 3.2 | 9.15 | 1.09 | 4.7 |
| 温度范围/℃ | 固体质量/g |
| 150~210 | 4.41 |
| 290~320 | 2.41 |
| 890~920 | 2.25 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com