
| 弱酸 | CH3COOH | HCN | H2CO3 |
| Ka | 1.8×10-5 | 4.9×10-10 | K1=4.3×10-7K2=5.6×10-11 |
| A、0.1 mol/L 的CH3COOH的 pH比0.1mol/L HCN的pH大 |
| B、等物质的量浓度溶液pH关系:pH(CH3COONa)<pH(NaHCO3)<pH(NaCN) |
| C、向NaCN溶液中通入少量CO2:CO2+H2O+2NaCN═2HCN+Na2CO3 |
| D、NaHCO3和Na2CO3的混合液中:c(Na+)+c(H+)=c(OH-)+c(HCO3-)+c(CO32-) |


科目:高中化学 来源: 题型:
| A、苯、水、四氯化碳三种无色液体不用试剂就可以鉴别开来 |
| B、甘氨酸既能与HCl反应又能与NaOH反应,所以甘氨酸是两性氧化物 |
| C、检验淀粉是否已完全水解,只需要向水解混合液中加银氨溶液并水浴加热即可 |
| D、等质量的C3H6、C4H10、C6H6完全燃烧,耗氧最多的是C6H6 |
查看答案和解析>>
科目:高中化学 来源: 题型:


查看答案和解析>>
科目:高中化学 来源: 题型:
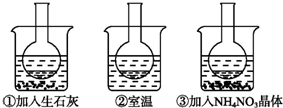 如图所示三个烧瓶中分别装入含酚酞的0.01mol?L-1 CH3COONa溶液,并分别放置在盛有水的烧杯中,然后向烧杯①中加入生石灰,烧杯②中不加任何物质,向烧杯③中加入NH4NO3晶体.
如图所示三个烧瓶中分别装入含酚酞的0.01mol?L-1 CH3COONa溶液,并分别放置在盛有水的烧杯中,然后向烧杯①中加入生石灰,烧杯②中不加任何物质,向烧杯③中加入NH4NO3晶体.查看答案和解析>>
科目:高中化学 来源: 题型:
| 高温高压 |
| 催化剂 |
| A、降低温度可以加快反应速率 |
| B、达到化学反应限度时,生成2molNH3 |
| C、向容器中再加入N2,可以加快反应速率 |
| D、1mol N2和3mol H2的总能量低于2mol NH3的总能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| ||
| A、反应①中Cl2是还原剂 |
| B、反应①中碳元素被还原 |
| C、反应②中钛元素被氧化 |
| D、反应②中TiCl4是氧化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①③ | B、②④ | C、①④ | D、②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:
2- 3 |
2- 6 |
| A、Fe2+、S2O32-都是还原剂 |
| B、每生成1molFe3O4,则转移电子数为3mol |
| C、硫元素被氧化,铁元素被还原 |
| D、x=2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com