
| n |
| V |


 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
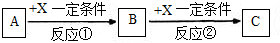
查看答案和解析>>
科目:高中化学 来源: 题型:
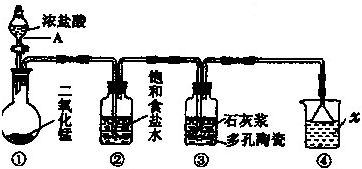
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
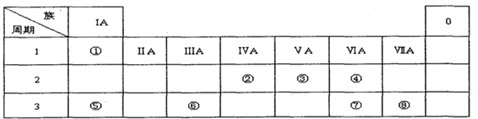
| 族 周期 | ⅠA | 0 | ||||||
| 1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | ② | ③ | ④ | |||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ||||
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、FeCl2溶液中通入Cl2:2Fe2++Cl2=2Fe3++2Cl- |
| B、澄清石灰水与少量小苏打溶液混合:Ca2+十OH-+HCO3-=CaCO3↓+H2O |
| C、FeS固体放人稀硝酸溶液中:FeS+2H+=Fe2++H2S↑ |
| D、AlCl3溶液中加入过量氨水:Al3++3OH-=Al(OH)3-↓ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com