
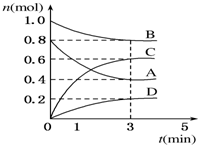
 T℃时,在容积为0.5L的密闭容器中发生如 下反应.mA(g)+nB(g)?pC(g)+qD(s)△H<0(m、n、p、q为最简整数比).A、B、C、D的物质的量变化如图所示.
T℃时,在容积为0.5L的密闭容器中发生如 下反应.mA(g)+nB(g)?pC(g)+qD(s)△H<0(m、n、p、q为最简整数比).A、B、C、D的物质的量变化如图所示.分析 图象分析可知反应物为AB,生成物为CD,A消耗物质的量0.8mol-0.4mol=0.4mol,B消耗物质的量=1.0mol-0.8mol=0.2mol,C生成物质的量=0.6mol,D生成物质的量0.2mol,反应物质的量之比等于化学方程式计量数之比=0.4:0.2:0.6:0.2=2:1:3:1,反应的化学方程式为:2A(g)+B(g)?3C(g)+D(s),反应是气体体积不变的放热反应,
(1)根据化学反应速率v=$\frac{△c}{△t}$来计算回答;
(2)平衡常数为产物浓度系数次幂的乘积与反应物浓度系数次幂的乘积的比值;
(3)根据影响化学平衡移动的因素来回答判断,
A.保持体积不变,通入2mol A和1mol B,增大压强,平衡不变;
B.D是固体,移走一部分D,不影响化学平衡;
C.把容器的体积缩小一倍,即加压,平衡不移动;
D.升高温度,平衡向吸热反应方向进行;
(4)根据浓度熵和平衡常数之间的关系判断反应进行的方向.
解答 解:(1)前3 min,v(C)=$\frac{△c}{△t}$=$\frac{\frac{0.6mol}{0.5L}}{3min}$=0.4 mol•L-1•min-1,
故答案为:0.4 mol•L-1•min-1;
(2)当达到平衡时,平衡常数K=$\frac{{c}^{3}(C)}{{c}^{2}(A)×c(B)}$=$\frac{(\frac{0.6}{0.5})^{3}}{(\frac{0.4}{0.5})^{2}×\frac{0.8}{0.5}}$=1.69,
故答案为:1.69;
(3)反应2A(g)+B(g)?3C(g)+D(s),达到平衡后,
A.保持体积不变,通入2mol A和1mol B,会使得A的转化率减小,故A错误;
B.D是固体,移走一部分D,平衡不移动,A的转化率不变,故B正确;
C.把容器的体积缩小一倍,即加压,平衡不移动,A的转化率不变,故C正确;
D.升高温度,平衡逆向移动,A的转化率减小,故D错误.
故答案为:BC.
(4)T℃时,容积为1 L的密闭容器中,起始充入0.2mol A、0.4 mol B、0.3 mol C、0.5mol D,此时Qc=$\frac{{c}^{3}(C)}{{c}^{2}(A)×c(B)}$=$\frac{0.{3}^{3}}{0.{2}^{2}×0.4}$=1.69=K,浓度商与平衡常数相等或Qc=K.仍然是平衡状态,故正逆反应速率相等,
故答案为:=.
点评 本题考查学生化学平常状态的判断、化学平衡移动的影响因素以及化学平衡计算等知识,注意知识的迁移和应用是关键,难度中等.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 甲 | 乙 | 丙 | |
| ① | Al(OH)3 | KOH溶液 | 稀硫酸 |
| ② | SiO2 | NaOH溶液 | 氢氟酸 |
| ③ | N2 | O2 | H2 |
| ④ | Cu | FeCl3溶液 | 浓硝酸 |
| A. | ①②③④ | B. | ①②④ | C. | ①③④ | D. | ①④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 质量为17 g | |
| B. | 含有6.02×1023个NH3分子 | |
| C. | 标准状况下的体积为44.8 L | |
| D. | 溶于1 L水后,液中NH4+的浓度为2 mol.L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 已知某可逆反应mA(g)+nB(g)?pC(g)在密闭容器中进行,如图表示在不同反应时间t时,温度T和压强p与反应物B在混合气体中的体积分数B%的关系曲线,由曲线分析,下列判断正确的是( )
已知某可逆反应mA(g)+nB(g)?pC(g)在密闭容器中进行,如图表示在不同反应时间t时,温度T和压强p与反应物B在混合气体中的体积分数B%的关系曲线,由曲线分析,下列判断正确的是( )| A. | T1<T2 p1>p2 m+n>p 放热反应 | B. | T1>T2 p1<p2 m+n>p 吸热反应 | ||
| C. | T1<T2 p1>p2 m+n<p 放热反应 | D. | T1>T2 p1<p2 m+n<p 吸热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电泳 | B. | 过滤 | C. | 布朗运动 | D. | 丁达尔效应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④⑤ | B. | ①③④⑤⑥ | C. | ①②③⑤⑥ | D. | 只有①②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 如图为实验室某浓盐酸试剂瓶上的标签,试根据有关数据回答下列问题:
如图为实验室某浓盐酸试剂瓶上的标签,试根据有关数据回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com