
| 实验步骤(不要求写出具体操作过程) | 预期实验现象和结论 |
| 取少量黑色固体,加入适量稀盐酸或稀硫酸, 在溶液中加入硫氰化钾溶液 | 溶液不变红色,则假设一成立, 溶液变成红色,则假设一不成立 |

分析 (1)向盛有草酸亚铁晶体的试管中滴入几滴硫酸酸化的KMnO4溶液,振荡,发现溶液颜色逐渐变为棕黄色,并检测到CO2生成.说明草酸亚铁被氧化为铁离子、二氧化碳气体,草酸亚铁具有还原性,依据电子守恒计算得到消耗的高锰酸钾物质的量;
(2)草酸亚铁晶体可完全分解,生成几种氧化物,残留物为黑色固体可能为氧化亚铁或四氧化三铁,分析判断;
(3)【定性研究】氧化亚铁溶解于盐酸生成氯化亚铁溶液,加入KSCN溶液,若溶液不变红证明假设一正确;
【定量研究】根据图中提供的信息,通过计算可以判断反应的化学方程式和物质的化学式.
解答 解:(1)向盛有草酸亚铁晶体的试管中滴入几滴硫酸酸化的KMnO4溶液,振荡,发现溶液颜色逐渐变为棕黄色,并检测到CO2生成.说明草酸亚铁被氧化为铁离子、二氧化碳气体,草酸亚铁具有还原性,依据电子守恒计算得到消耗的高锰酸钾物质的量,依据氧化还原反应电子守恒原子守恒配平书写离子方程式为5Fe2++5C2O42-+3MnO4-+24H+=5Fe3++3Mn2++5CO2↑+12H2O,消耗1mol FeC2O4•2H2O,则参加反应的KMnO4为0.6mol,
故答案为:还原性;0.6 mol;
(2)假设一:全部是氧化亚铁;假设二:全部是四氧化三铁;假设三:氧化亚铁和四氧化三铁的混合物,
故答案为:全部是四氧化三铁;氧化亚铁和四氧化三铁的混合物;
(3)【定性研究】实验步聚:取少量黑色固体,加入适量的稀盐酸(或稀硫酸)溶解,在溶液中加入KSCN溶液,现象与结论:若溶液不变红,则假设一成立,若溶液变红,则假设一不成立;
故答案为:
| 实验步骤(不要求写出具体操作程) | 预期实验现象和结论 |
| 加入适量稀盐酸或稀硫酸,在溶液中加入硫氰化钾溶液 | 溶液不变红色,则假设一成立,溶液变成红色,则假设一不成立 |
点评 本题考查了铁及其化合物性质的实验验证和实验分析判断,定量计算,图象分析是解题关键,题目难度较大.


科目:高中化学 来源: 题型:选择题
 常温下,将Cl2缓慢通入水中至饱和,然后向其中滴加0.1mol/LKOH溶液.整个实验过程溶液中c(OH-)的变化曲线如图所示,不考虑次氯酸分解,下列叙述正确的是( )
常温下,将Cl2缓慢通入水中至饱和,然后向其中滴加0.1mol/LKOH溶液.整个实验过程溶液中c(OH-)的变化曲线如图所示,不考虑次氯酸分解,下列叙述正确的是( )| A. | a点对应溶液中含有的分子有H2O、HClO、HCl、Cl2 | |
| B. | b点对应溶液中:c(H+)>c(Cl-)>c(HClO)>c(ClO-)>c(OH-) | |
| C. | c点对应溶液中:c(K+)=c(Cl-)+c(ClO-)+c(HClO) | |
| D. | 实验过程中可以用pH试纸测定溶液的pH |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
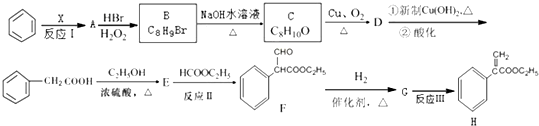
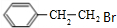 ;E的分子式为C10H12O2;F中含氧官能团的名称是醛基、酯基.
;E的分子式为C10H12O2;F中含氧官能团的名称是醛基、酯基. .
.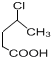 制备
制备 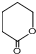 的合成路线流程
的合成路线流程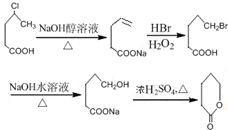 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H3PW12O40在该酯化反应中起催化作用 | |
| B. | 杂多酸盐Na2HPW12O40与Na3PW12O40都是强电解质 | |
| C. | H3PW12O40、KH2PW12O40与Na3PW12O40中含有的原子团不同 | |
| D. | 硅钨酸H4SiW12O40也是一种杂多酸,其中W的化合价为+6 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Q1>Q2 | B. | Q1=Q2 | C. | 2Q1>Q2 | D. | Q2=Q1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | “纳米碳”属于“纳米材料”,若将纳米碳均匀地分散到蒸馏水中,所形成的物质能透过滤纸,不能透过半透膜,静置后会析出黑色沉淀 | |
| B. | 维生素C又称“抗坏血酸”,在人体内有重要的功能,是因为维生素C具有氧化性 | |
| C. | 表面打磨过的铝箔,在空气中加热至熔化也不滴落是因为表面生成了熔点很高的氧化铝薄膜包裹在铝的外面 | |
| D. | 氨很容易液化,液化时放热,液化后得到氨水 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
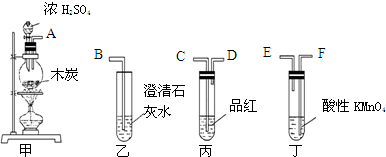
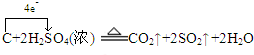 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
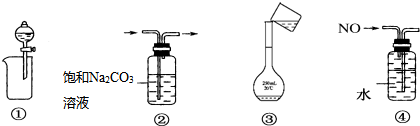
| A. | ①分离出BaSO4浊液中的BaSO4 | B. | ②除去CO2中少量HCl气体 | ||
| C. | ③将溶液转移到容量瓶中 | D. | ④排水法收集NO |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com