
| A、将40g NaOH溶解于1L水中,得到1mol?L-1的NaOH溶液 |
| B、将11.2L HCl气体通入水中配成0.5L溶液,浓度为1mol?L-1 |
| C、将1L 10 mol?L-1的盐酸与9L水混合,混合液浓度为1mol?L-1 |
| D、10g NaOH溶解在水中配成250mL溶液,其浓度为1mol?L-1 |
| m |
| M |
| n |
| V |
| m |
| M |
| 10g |
| 40g/mol |
| n |
| V |
| 0.25mol |
| 0.25L |


 暑假作业安徽少年儿童出版社系列答案
暑假作业安徽少年儿童出版社系列答案科目:高中化学 来源: 题型:
| A、碳酸氢钙CaHCO3 |
B、氯离子的结构示意图为: |
| C、氦气 He2 |
| D、硫酸的电离方程式:H2SO4=H2++SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、全部正确 | B、②④ |
| C、②③④ | D、②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 共价键类型 | C-C | C=C | C-H |
| 键能kJ/mol | 332 | 611 | 414 |
| A、C3H8、C2H4、CH4互为同系物 |
| B、C-C比C=C更活泼 |
| C、若1 mol C3H8完全反应,能够吸收53 kJ的热量 |
| D、可用酸性高锰酸钾除去混合气体中的C2H4,得到纯净的CH4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
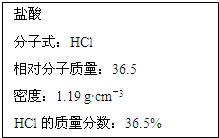 如图为实验室某浓盐酸试剂瓶标签上的有关数据,试根据标签上的有关数据回答下列问题:
如图为实验室某浓盐酸试剂瓶标签上的有关数据,试根据标签上的有关数据回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
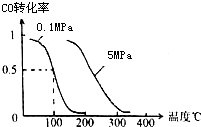 (1)在一定条件下,容积为 100L密闭容器中发生反应:
(1)在一定条件下,容积为 100L密闭容器中发生反应:查看答案和解析>>
科目:高中化学 来源: 题型:


查看答案和解析>>
科目:高中化学 来源: 题型:
A Z |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com