
配制250mL1mol/L的稀盐酸溶液,需要12mol/L的浓盐酸的体积为( )
|
| A. | 12mL | B. | 25mL | C. | 21mL | D. | 12.5mL |
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
有机化学反应因反应条件不同,可生成不同的有机产品。例如:
HX + 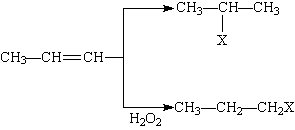 (X为卤素原子)
(X为卤素原子)
工业上利用上述信息,按下列路线合成结构简式为 的物质,该物质是一种香料。
的物质,该物质是一种香料。

请根据上述路线,回答下列问题:
(1)A的结构简式可能为____________________________________。
(2)反应①、③、⑤的反应类型分别为________、________、_______。
(3)反应④的化学方程式为(有机物写结构简式,并注明反应条件):
_________________________________________________________。
(4)工业生产中,中间产物A须经反应③④⑤得D,而不采取直接转化为D的方法,其原因是_______________________________________。
(5)这种香料具有多种同分异构体,其中某些物质有下列特征:①其水溶液遇FeCl3溶液呈紫色 ②分子中有苯环,且苯环上的一溴代物有两种。写出符合上述条件的物质可能的结构简式(只写两种):
_____________________________,_______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
如图所示是分离混合物时常用的仪器,从左至右,可以进行的混合物分离操作分别是( )
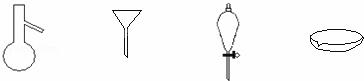
|
| A. | 蒸馏、蒸发、萃取、过滤 | B. | 蒸馏、过滤、萃取、蒸发 |
|
| C. | 萃取、过滤、蒸馏、蒸发 | D. | 过滤、蒸发、萃取、蒸馏 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是( )
|
| A. | 1mol任何气体所占体积都约为22.4L |
|
| B. | 1molH2O在标准状况下体积为22.4L |
|
| C. | 1mol气体体积为22.4L,则一定是标准状况 |
|
| D. | 气体摩尔体积不一定是22.4L/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组离子在指定溶液中一定能大量共存的是
A.无色溶液中可能大量存在Al3+、NH 、Cl-、AO2-
、Cl-、AO2-
B.酸性溶液中可能大量存在Na+、MnO4-、SO 、I-
、I-
C.弱碱性溶液中可能大量存在Na+、K+、Cl-、HCO
D.0.1 mol·L-1FeCl3溶液中:Fe2+、NH 、SCN-、SO42-
、SCN-、SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
已知0.1 mol·L-1的醋酸溶液中存在电离平衡:CH3COOH CH3COO-+H+,要使溶液中c(H+)/c(CH3COOH)值增大,可以采取的措施是
CH3COO-+H+,要使溶液中c(H+)/c(CH3COOH)值增大,可以采取的措施是
①加少量烧碱 ②升高温度 ③加少量冰醋酸 ④加水
A.①② B.②④
C.②③④ D.①④
查看答案和解析>>
科目:高中化学 来源: 题型:
已知H2CO3的电离平衡常数Ka1=4.4×10-7,Ka2=4.7×10-11。向0.1mol/LNaOH溶液中通入CO2,若溶液的pH=10(不考虑溶液的体积变化),则下列说法正确的是
A. 2c(CO32-)+c(HCO3-)=0.1mol/L
B. 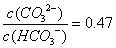
C. 该溶液中加BaCl2溶液,溶液pH增大
D. 在溶液中加水,使体积扩大到原来的10倍,则溶液pH明显变小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com