
| A. | 从阴离子HS-电离出H+比从H2S电离出H+更难 | |
| B. | H2S电离出的H+会抑制HS-的电离 | |
| C. | 溶液中c(H+)与c(HS-)接近于相等且c(H+)略大于c(HS-) | |
| D. | 溶液中c(H+)=2c(S2-) |
分析 A.H2S溶液中存在着电离平衡H2S?H++HS-,HS-?S2-+H+,以第一步为主;
B.H2S溶液中两步电离以第一步为主,第一步电离出的H+抑制第二步的电离;
C.H2S溶液中存在着电离平衡H2S?H++HS-,HS-?S2-+H+,以第一步为主,第二步电离程度很小;
D.第二步电离HS-?S2-+H+电离出c(H+)=c(S2-),而第一步电离程度远大于第二步电离.
解答 解:A.H2S溶液中存在着电离平衡H2S?H++HS-,HS-?S2-+H+,以第一步为主,第一步电离出的H+抑制第二步的电离,故A正确;
B.H2S溶液中两步电离以第一步H2S?H++HS-为主,H2S?H++HS-电离出的H+抑制第二步HS-?S2-+H+的电离,故B正确;
C.H2S溶液中电离以第一步为主,第二步电离程度很小,导致溶液中c(H+)与c(HS-)接近于相等且c(H+)略大于c(HS-),故C正确;
D.第二步电离HS-?S2-+H+电离出c(H+)=c(S2-),而第一步电离程度远大于第二步电离,所以溶液中c(H+)>2c(S2-),故D错误;
故选:D.
点评 本题考查了弱电解质电离平衡的影响因素分析,明确弱电解质电离特点是解本题关键,注意浓度对平衡移动的影响,难度不大.


 轻松暑假总复习系列答案
轻松暑假总复习系列答案科目:高中化学 来源: 题型:选择题
| A. | 第一电离能:O>N | B. | 水溶性:CH3CH2OH>CH3OCH3 | ||
| C. | 沸点:H2S>H2O | D. | 晶格能:NaCl>MgO |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.20 mol/L | B. | 0.15 mol/L | C. | 0.10 mol/L | D. | 0.05 mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
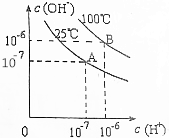
| A. | 25℃时,0.1mol/LNaOH溶液与0.1mol/L乙酸溶液等体积混合,所得溶液的pH等于7 | |
| B. | 25℃时,pH=11的氨水与pH=3的盐酸等体积混合,所得溶液的pH小于7 | |
| C. | 100℃时,pH=12的NaOH溶液aL和pH=2的H2SO4溶液bL恰好中和,则a:b=1:1 | |
| D. | 100℃时,pH=12的NaOH溶液和pH=9的NaOH溶液等体积混合,所得溶液的pH约为11.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A.装置可说明浓H2SO4具有脱水性、强氧化性,SO2具有漂白性、还原性 | B.装置可除去CO2中含有的少量HCl | C.装置可制备氨气 | D.装置可制取、收集并吸收多余的HCl |
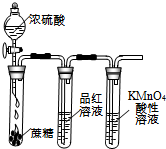 |  | 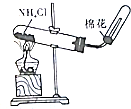 | 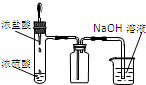 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源:2017届福建省高三上第二次月考化学试卷(解析版) 题型:选择题
把Ba(OH)2溶液滴入明矾[KAl(SO4)2·12H2O]溶液中,使SO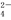 全部转化成BaSO4沉淀,此时铝元素的主要存在形式是( )
全部转化成BaSO4沉淀,此时铝元素的主要存在形式是( )
A.Al3+ B.Al(OH)3 C.AlO2- D.Al3+和Al(OH)3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com