
| A、10℃10mL 4mol/L的盐酸溶液 |
| B、20℃10mL 4mol/L的盐酸溶液 |
| C、20℃20mL 2mol/L的盐酸溶液 |
| D、20℃40mL 2mol/L的盐酸溶液 |
 浙江名校名师金卷系列答案
浙江名校名师金卷系列答案科目:高中化学 来源: 题型:
 碳酸镁晶须是一种新型的吸波隐形材料中的增强材料.已知某碳酸镁晶须样品的组成为MgCO3?nH2O (n为1~5的正整数),通过对其进行热重分析得到如图所示的热重曲线,试根据曲线计算n=
碳酸镁晶须是一种新型的吸波隐形材料中的增强材料.已知某碳酸镁晶须样品的组成为MgCO3?nH2O (n为1~5的正整数),通过对其进行热重分析得到如图所示的热重曲线,试根据曲线计算n=查看答案和解析>>
科目:高中化学 来源: 题型:
| A、糖类、蛋白质都属于天然高分子化合物 |
| B、强紫外线灼伤人体皮肤属于皮肤蛋白质的变性 |
| C、纤维素和淀粉的组成都可用(C6H10O5)n表示,它们互为同分异构体 |
| D、向鸡蛋清溶液中分别加入饱和(NH4)2SO4和CuSO4溶液都能使之聚沉,其原理相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Z元素在周期表中的位置为二周期第ⅥA族 |
| B、原子半径:W>Z>Y>X |
| C、1mol甲与足量的乙完全反应共转移了2mol电子 |
| D、1L 0.1mol/L戊溶液中阴离子总的物质的量小于0.1mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
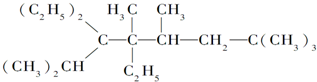
| y |
| 2 |
| (y-x) |
| 2 |
| (y+2-x) |
| 2 |
| (2x+2-y) |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 汽车在现代生活中扮演着越来越重要的角色,但其尾气(碳氢化合物、氮氧化物及一氧化碳等)带来的环境污染越来越明显,机动车废气排放已成为城市大气污染的重要来源.
汽车在现代生活中扮演着越来越重要的角色,但其尾气(碳氢化合物、氮氧化物及一氧化碳等)带来的环境污染越来越明显,机动车废气排放已成为城市大气污染的重要来源.| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
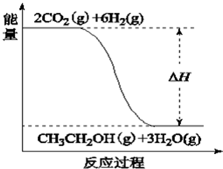 A、B、C、D是中学化学常见的四种物质,它们的转化关系为:A+B═C+D
A、B、C、D是中学化学常见的四种物质,它们的转化关系为:A+B═C+D查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com