
 (I)表中①~⑥均是由Na、Mg、H、O、S、Cl等元素中的几种组成,根据物质的组成和性质将它们进行了分类.
(I)表中①~⑥均是由Na、Mg、H、O、S、Cl等元素中的几种组成,根据物质的组成和性质将它们进行了分类.| 物质类别 | 含氧强酸 | 碱 | 钠盐 |
| 化学式 | ①H2SO4②HClO4 | ③ ④Mg(OH)2 ④Mg(OH)2 | ⑤NaCl ⑥Na2SO3 |
 .
.分析 (I)(1)由Na、Mg、H、O、S、Cl等元素中的几种组成的含氧强酸是高氯酸,碱有氢氧化钠,氢氧化镁等;
(2)亚硫酸钠和硫酸之间反应生成硫酸钠水以及二氧化硫,据此书写离子方程式;
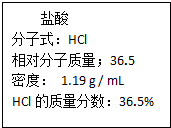
(II)(1)根据c=$\frac{1000ρw%}{M}$来计算浓度;
(2)根据稀释前后溶质的物质的量不变来计算,结合实验步骤确定实验用到的仪器,根据c=$\frac{n}{V}$并结合溶质的物质的量n和溶液的体积V的变化来进行误差分析;
(3)①盐酸和强氧化钠的物质的量相等时恰好中和,据此计算;
②盐酸中和含0.4g NaOH的氢氧化钠溶液,发现实际所用体积偏小,说明在配置的过程中,操作不当导致所配盐酸浓度偏低,据此回答.
解答 解:(I)(1)由Na、Mg、H、O、S、Cl等元素中的几种组成的含氧强酸是高氯酸,碱可以是氢氧化钠,氢氧化钠是离子化合物,电子式为: ;故答案为:HClO4;
;故答案为:HClO4; ;
;
(2)亚硫酸钠和硫酸之间反应生成硫酸钠水以及二氧化硫,离子方程式为:2H++SO32-═H2O+SO2↑;故答案为:2H++SO32-═H2O+SO2↑;
(II)(1)c=$\frac{1000ρw%}{M}$=$\frac{1000×1.19×36.5%}{36.5}$mol/L=11.9mol/L,故答案为:11.9;
(2)①11.9mol/L的浓盐酸来配置500mL物质的量浓度为0.400mol/L的稀盐酸,根据稀释前后溶质的物质的量不变需要浓盐酸的体积=$\frac{0.5L×0.400mol/L}{11.9mol/L}$≈0.0168L=16.8mL,故答案为:16.8;
②实验用到的玻璃仪器:量筒、烧杯、玻璃棒、500mL容量瓶、胶头滴管,故答案为:500mL容量瓶、胶头滴管;
③用量筒量取浓盐酸时俯视读数,则溶液的体积偏大,所以浓度偏低,定容后经振荡、摇匀、静置,发现液面下降,再加适量蒸馏水,相当于将溶液稀释,体积偏大,所以浓度偏低,故答案为:偏低;偏低;
(3)①盐酸和强氧化钠的物质的量相等时恰好中和,需要盐酸的体积V=$\frac{\frac{0.4g}{40g/mol}}{0.400mol/L}$=0.025L=25mL,故答案为:25;
②盐酸中和含0.4g NaOH的氢氧化钠溶液,发现实际所用体积偏小,说明在配置的过程中,操作不当导致所配盐酸浓度偏低,
A.盐酸挥发,浓度不足,则实际所用体积偏大,故错误;
B.配置过程中未洗涤烧杯和玻璃棒,则实际所用体积偏大,故错误;
C.配置溶液定容时,俯视容量瓶刻度线,盐酸浓度偏高,则实际所用体积偏小,故正确;
D.加水超过刻度线,用胶头滴管吸出,盐酸浓度偏低,则实际所用体积偏大,故错误;
故选C.
点评 本题考查了物质的分类以及一定物质的量浓度溶液的配制过程中的计算和误差分析,属于基础型题目,难度不大.


 小学生10分钟口算测试100分系列答案
小学生10分钟口算测试100分系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 醋酸铵溶液和盐酸反应:CH3COONH4+H+═CH3COOH+NH4+ | |
| B. | 碳酸氢铵溶液和过量氢氧化钠溶液:NH4++OH-═NH3•H2O | |
| C. | 偏铝酸钠溶液和过量盐酸:AlO2-+4H+═Al3++2H2O | |
| D. | 钠跟水反应:Na+2H2O═Na++2OH-+H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲苯和丙三醇 | B. | 乙醇和丙烯 | C. | 甲烷和乙烯 | D. | 苯和丁炔 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe3O4溶解在过量的稀硝酸中:Fe3O4+8H+═Fe2++2Fe3++4H2O | |
| B. | 向NaAlO2溶液中通入少量CO2:2AlO2-+CO2+3H2O═2Al(OH)3↓+CO32- | |
| C. | 向AlCl3溶液中加入过量的NH3•H2O:Al3++4NH3•H2O═AlO2-+4NH4++2H2O | |
| D. | 用铜除去CuCl2 溶液中少量的FeCl3:Fe2++Cu═Fe3++Cu2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
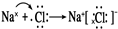
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com