
п�̸ɵ�������������ʹ�������϶̣���Ϊһ���Ե�أ�����֮���������ӵ����ⲻ���˷��˱���Ľ�����Դ�����һ���������صĻ�����Ⱦ���±��Ǹ����ص��ۺϳɷַ��������
| Ԫ�� | п[��Դ��ȫ,Ʒ����&��*��+��] | �� | �� | ͭ | ̼ | ���� |
| �����ٷֺ��� | 13��27 | 14��28 | 23��26 | 0.5��0.7 | 5��6 | 13 |
ͨ���Ļ�е������������и���ֽ���������ȵķ��룬�Ӷ�ʹ�����������̵õ����ٷֱ��пƤ���̷ۣ�MnO2������ʪ��������ͨ��Ԥ��������ȡ�������ȹ����Ƴ���Ʒ��������������ͼ��
��������֪�����ӳ�����ȫ��pHΪ
| ���� | Fe3+ | Fe2+ | Cu2+ | Mn2+ |
| pH | 3.2 | 9.0 | 6.7 | 10.1 |
��֪��пԪ������Ԫ�����ƣ��������ԡ�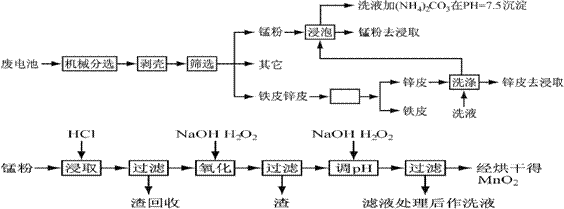
1������п�̸ɵ��Ϊ���Ե�أ��������ҺΪKOH,����������ӦΪ ��
�缫�ܷ�Ӧ����Ϊ ��
2����Ԥ�����У�������Ƥ��пƤ�ķ����� ��ϴҺ��(NH4)2CO3��pH��7.5������һ�ּ�ʽ�Σ������ʵĻ�ѧʽΪ ��
3���������������У�д������30%�����ܽ�ʱ�����ӷ���ʽ �������ܽ����յ����� ��
4����֪�ڶ��μ�H2O2�����pH��9��Ŀ��Ϊ��Mn2+ת��ΪMnO2,���һ�μ�H2O2�����pH��5��Ŀ���� ��
5��ʵ�������ø��������Һ����Mn2+ʱ��������ɫ�������÷�Ӧ�����ӷ���ʽΪ
��
6���������ڸ��������¿��Եõ�������������ȷֽ�ķ���ʽΪ ��
��֪ʶ�㡿�������Ӽ��顢���ӡ��绯ѧ�����ӷ���ʽ����д
���𰸽����� 1��2MnO2+2H2O+2e-=2MnOOH+2OH- (1��)
2MnO2+2H2O+Zn=2MnOOH+Zn(OH)2 (1��)
2����ѡ�����ô����� ��1�֣� Zn2(OH)2CO3 (2��)
3��MnO2+4H++2Cl- Mn2++Cl2��+2H2O (2��) ̼�ڣ���̼�� ��1�֣�
Mn2++Cl2��+2H2O (2��) ̼�ڣ���̼�� ��1�֣�
4����ȥFe2+��Fe3+ ��2�֣�
5��2MnO4-+3Mn2++4OH-=5MnO2+2H2O (2��)
6��3MnSO4 Mn3O4+SO2��+SO3�� (2��)
Mn3O4+SO2��+SO3�� (2��)
������1��п�̸ɵ�ظ���Ϊп��ʧ���ӣ�����Ϊʯī���������̵õ�������MnOOH�������缫��Ӧʽ��2MnO2+2H2O+2e-=2MnOOH+2OH-���ܷ�Ӧ����ʽ��
2MnO2+2H2O+Zn=2MnOOH+Zn(OH)2��
2����Ԥ�����У�������Ƥ��пƤ�ķ����Ǵ�ѡ�����ô�������ϴҺ��(NH4)2CO3��pH��7.5������һ�ּ�ʽ�Σ��������Ǽ�ʽ̼��п����ѧʽΪZn2(OH)2CO3��
3���������������У�����30%�����ܽ�ʱ�������Ȼ��̺����������ӷ���ʽΪ��
MnO2+4H++2Cl- Mn2++Cl2��+2H2O�� �����ܽ����յ�����̼�ڣ�
Mn2++Cl2��+2H2O�� �����ܽ����յ�����̼�ڣ�
4����һ�μ�H2O2���������������������ӣ�����pH��5������������ȫ��������Ŀ���dz�ȥFe2+��Fe3+��
5���������������Mn2+���ɺ�ɫ��MnO2������ʽ��2MnO4-+3Mn2++4OH-=5MnO2+2H2O
6���������ڸ��������¿��Եõ���������������̡�������������������ʽ��
3MnSO4 Mn3O4+SO2��+SO3��[��Դ��ȫ,Ʒ����&��*��+��]
Mn3O4+SO2��+SO3��[��Դ��ȫ,Ʒ����&��*��+��]
��˼·�㲦�������Լ���п�̵��Ϊ���ݿ����˵缫��Ӧʽ��д��������ԭ��Ӧ����ʽ��д���ֽⷴӦ�ȣ�ע�������е���Ϣ���Ѷ��еȡ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�����£����и���������ָ����Һ��һ���� ������
������ ����� (����)
����� (����)
A��0.1 mol·L��1 NaOH��Һ��K����Na����SO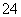 ��CO
��CO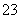
B��0.1 mol·L��1 Na2CO3��Һ��K����Ba2����NO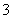 ��Cl��
��Cl��
C��0.1 mol·L��1 FeCl3��Һ��K����NH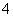 ��I����SCN��
��I����SCN��
D��c(H��)/c(OH��)��1��1014����Һ��Ca2����Na����ClO����NO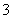
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
ij�ֳ���¯��������Ҫԭ���ǽ�̿��������(��Ҫ�ɷ���Fe2O3)�������ȡ���Ҫ��Ӧ��������ͼ��ʾ��

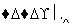


 ��������,
��������,
(1)����ͼ������д���йط�Ӧ������Ļ�ѧʽ��
(2)д���٢�������Ӧ�Ļ�ѧ����ʽ��
________________________________________________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
CO2��CH4��������Ҫ���������壬ͨ��CH4��CO2��Ӧ�������ֵ��ѧƷ��Ŀǰ���о�Ŀ�ꡣ
��1��250��ʱ�������Ͻ�Ϊ��������4 L������ͨ��6 mol CO2��6 mol CH4���������·�Ӧ��CO2 (g)��CH4(g) 2CO(g)��2H2(g)��ƽ����ϵ�и��������������±���
2CO(g)��2H2(g)��ƽ����ϵ�и��������������±���
| ���� | CH4 | CO2 | CO | H2 |
| ������� | 0.1 | 0.1 | 0.4 | 0.4 |
�ٴ��¶��¸÷�Ӧ��ƽ�ⳣ��K=__________
����֪��CH4(g)��2O2(g)��CO2(g)��2H2O(g) ��H=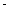 890.3 kJ·mol��1
890.3 kJ·mol��1
CO(g)��H2O (g)��CO2(g)��H2 (g) ��H=+2.8 kJ·mol��1
2CO(g)��O2(g)��2CO2(g) ��H=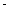 566.0 kJ·mol��1
566.0 kJ·mol��1
��ӦCO2(g)��CH4(g) 2CO(g)��2H2(g) �ġ�H=________________
2CO(g)��2H2(g) �ġ�H=________________
��2���Զ������ѱ��渲��Cu2Al2O4Ϊ���������Խ�CO2��CH4ֱ��ת�������ᡣ
���ڲ�ͬ�¶��´����Ĵ�Ч���������������������ͼ��ʾ��250��300��ʱ���¶����߶�������������ʽ��͵�ԭ����_____________________
��Ϊ����߸÷�Ӧ��CH4��ת���ʣ����Բ�ȡ�Ĵ�ʩ��________________________
�۽�Cu2Al2O4�ܽ���ϡ�����е����ӷ���ʽΪ___________________________
��3��Li2O��Na2O��MgO��������CO2�������Ѱ������CO2���������ʣ����н����������______
a.���ڼ�����������Ѱ��
b.���ڢ�A����A��Ԫ���γɵ���������Ѱ��
c.���ھ���ǿ�����Ե�������Ѱ��
��Li2O����CO2�������ںϳ�Li4SiO4��Li4SiO4�������ա��ͷ�CO2��ԭ���ǣ���500�棬CO2��Li4SiO4�Ӵ�������Li2CO3��ƽ��������700�棬��Ӧ������У��ų�CO2��Li4SiO4������˵����ԭ���Ļ�ѧ����ʽ��___________________________
��4�����÷�ӦA�ɽ��ͷŵ�CO2ת��Ϊ���й�ҵ���ü�ֵ�IJ�Ʒ��
��ӦA��
���µ�⼼���ܸ�Чʵ�֣�3���з�ӦA������ԭ��ʾ��ͼ���£�
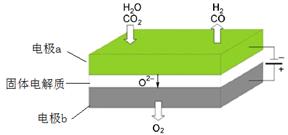
CO2�ڵ缫a�ŵ�ķ�Ӧʽ��_____________________________________________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
CO2��CH4��������Ҫ���������壬ͨ��CH4��CO2��Ӧ�������ֵ��ѧƷ��Ŀǰ���о�Ŀ�ꡣ
��1��250��ʱ�������Ͻ�Ϊ��������4 L������ͨ��6 mol CO2��6 mol CH4���������·�Ӧ��CO2 (g)��CH4(g) 2CO(g)��2H2(g)��ƽ����ϵ�и��������������±���
2CO(g)��2H2(g)��ƽ����ϵ�и��������������±���
���� | CH4 | CO2 | CO | H2 |
������� | 0.1 | 0.1 | 0.4 | 0.4 |
�ٴ��¶��¸÷�Ӧ��ƽ�ⳣ��K=__________
����֪��CH4(g)��2O2(g)��CO2(g)��2H2O(g) ��H= 890.3 kJ��mol��1
890.3 kJ��mol��1
CO(g)��H2O (g)��CO2(g)��H2 (g) ��H=+2.8 kJ��mol��1
2CO(g)��O2(g)��2CO2(g) ��H= 566.0 kJ��mol��1
566.0 kJ��mol��1
��ӦCO2(g)��CH4(g) 2CO(g)��2H2(g) �ġ�H=________________[��Դ��ȫ,Ʒ����&��*��+��]
2CO(g)��2H2(g) �ġ�H=________________[��Դ��ȫ,Ʒ����&��*��+��]
��2���Զ������ѱ��渲��Cu2Al2O4Ϊ���������Խ�CO2��CH4ֱ��ת�������ᡣ
���ڲ�ͬ�¶��´����Ĵ�Ч���������������������ͼ��ʾ��250��300��ʱ���¶����߶�������������ʽ��͵�ԭ����_____________________

��Ϊ����߸÷�Ӧ��CH4��ת���ʣ����Բ�ȡ�Ĵ�ʩ��________________________
�۽�Cu2Al2O4�ܽ���ϡ�����е����ӷ���ʽΪ___________________________
��3��Li2O��Na2O��MgO��������CO2�������Ѱ������CO2���������ʣ����н����������______
a.���ڼ�����������Ѱ��
b.���ڢ�A����A��Ԫ���γɵ���������Ѱ��
c.���ھ���ǿ�����Ե�������Ѱ��
��Li2O����CO2�������ںϳ�Li4SiO4��Li4SiO4�������ա��ͷ�CO2��ԭ���ǣ���500�棬CO2��Li4SiO4�Ӵ�������Li2CO3��ƽ��������700�棬��Ӧ������У��ų�CO2��Li4SiO4������˵����ԭ���Ļ�ѧ����ʽ��___________________________
��4�����÷�ӦA�ɽ��ͷŵ�CO2ת��Ϊ���й�ҵ���ü�ֵ�IJ�Ʒ��
��ӦA��
���µ�⼼���ܸ�Чʵ�֣�3���з�ӦA������ԭ��ʾ��ͼ���£�

CO2�ڵ缫a�ŵ�ķ�Ӧʽ��_____________________________________________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��չ��϶�������ʵʩ���ܼ��ŵ���Ҫ��ʩ֮һ����϶������ĵ綯��Ŀǰһ��ʹ�õ��������ء��������»����ʱ���綯���ṩ�ƶ��������������͵����ģ���ɲ��������ʱ�綯�����ڳ��״̬�Խ�ʡ�ܺġ������ز������Ļ�����Ϊ�����������������M��ʾ��Ϊ��������Һ����ҪΪKOH��Ϊ���Һ�������س�ŵ�ԭ����ͼ�����ܷ�ӦʽΪ�� H2+2NiOOH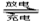 2Ni(OH)2
2Ni(OH)2
�����йػ�϶��������ж���ȷ���ǣ�������
A.�����»����ʱ��ÿ����22.4LH2���ӵ缫������缫�ҵĵ�����2mol
B�������»����ʱ���ҵ缫��Χ��Һ��pH����С
C����ɲ��������ʱ����Һ�е�K+���ҵ缫Ǩ��
D����ɲ��������ʱ���缫�ĵ缫��ӦʽΪ2H2O+2e-=H2��+2OH-
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��ͭ������������ຬ��Cu��Au���𣩺�PbSO4�����ʣ�ʪ����������������ۺ����õ��������£�
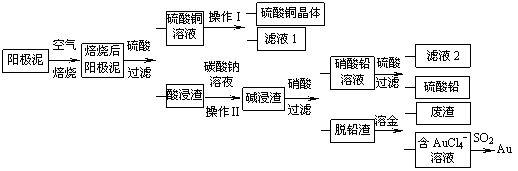

��1����CuSO4�����Һ��⺬ͭ����Ǧ�Ĵ�ͭ�������ĵ缫��Ӧʽ�У� ��Cu-2e��= Cu2+��
��2������������ʱ��Ϊ����߱���Ч�ʣ���ȡ�ĺ�����ʩ�� �����պ���������г�����PbSO4�⣬���� ���ѧʽ����
��3������I����Ҫ����Ϊ ��������������� ��
��4��д����SO2��ԭAuCl4�������ӷ���ʽ ��
��5��Ϊ�˼��ٷ�Һ�ŷš��������������Դ����ҵ�Ͻ���Һ1��������ͭ��Һ����ѭ����������ָ������ͼ����һ�����Ƶ����� ��
��6����֪298Kʱ��Ksp(PbCO3)=1.46��10-13��Ksp(PbSO4)= 1.82��10-8�������ӷ���ʽ��ʾ����̼������Һ������ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��������I��II����ȷ�����������ϵ����
| ѡ�� | ����I | ����II |
| A | NH4ClΪǿ�������� | �ü��ȷ���ȥNaCl�е�NH4Cl |
| B | Fe3+���������� | ��KSCN��Һ���Լ���Fe3+ |
| C | �ܽ�ȣ�CaCO3<Ca(HCO3)2 | �ܽ�ȣ�Na2CO |
| D | SiO2����HF��Ӧ | �����ܱ����ڲ���ƿ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��ͼ��ʾ ����������ʵ�����Ʊ�������ˮFeCl3����������˳����ȷ����
����������ʵ�����Ʊ�������ˮFeCl3����������˳����ȷ����

A��a-b-c-d-e-e-f-g-h B.a-e-d-c-b-h-i-g
C��a-d-e-c-b-h-i-g D.a-c-b-d-e-h-i-f
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com