
下列有关说法正确的是
A.在轮船表面涂刷富锌油漆,能有效防止船体在海水中被腐蚀
B.0.1 mol·L-1氨水加水稀释后,溶液中 的值减小
的值减小
C.用pH均为2的盐酸和醋酸分别中和等物质的量的NaOH,消耗醋酸的体积更大
D.反应NH3(g)+HCl(g)=NH4Cl(s)在室温下可自发进行,则该反应的△H<0
科目:高中化学 来源:2014-2015河南省濮阳市高二上学期第三次月考化学试卷(解析版) 题型:填空题
(18分)依据氧化还原反应:2Ag+(aq)+Cu(s)===Cu2+(aq)+2Ag(s)设计的原电池,如图所示。请回答下列问题:

(1)电极X的材料是________;电解质溶液Y是________溶液。(填名称)
(2)银电极为电池的________极,发生的电极反应为____________________________;X电极上发生的电极反应为____________________________。
(3)外电路中的电子是从________极流向______极(填电极材料)。外电路中每通过0.1 mol电子,银电极的质量理论上增加 g。
(4)原电池工作时,盐桥(装有琼脂-KCl的U型管)里的Cl-移向 电极。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年辽宁省丹东五校协作体高三上学期期末考试理综化学试卷(解析版) 题型:选择题
某一元弱酸HA的相对分子质量为M。在t℃时,将a gHA完全溶解于水,得VmL饱和溶液,测得该溶液的密度为ρg·cm-3,其中n(A-)为b mol。下列叙述,错误的是
A.溶液中c(H+) =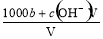
B.物质的量浓度c(HA) =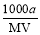 mol·L-1
mol·L-1
C.t℃时,HA的溶解度S =
D.HA的质量分数w(HA) =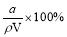
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江西省景德镇市高三第二次质检理综化学试卷(解析版) 题型:选择题
某芳香族化合物的分子式为C8H6O2,它的分子(除苯环外不含其它环)中不可能有
A.两个羟基 B.两个醛基 C.一个羧基 D.一个醛基
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江苏省镇江市高三第一学期期末调研测试化学试卷(解析版) 题型:填空题
(12分)硫化钠主要用于皮革、毛纺、高档纸张、染料等行业。生产硫化钠大多采用无水芒硝(Na2SO4)—炭粉还原法,其流程示意图如下:
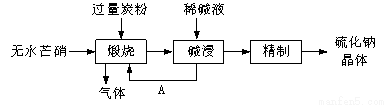
(1)若煅烧所得气体为等物质的量的CO和CO2,写出煅烧时发生的总的化学反应方程式为 。
(2)上述流程中采用稀碱液比用热水更好,理由是 。
(3)常温下,取硫化钠晶体(含少量NaOH)加入到硫酸铜溶液中,充分搅拌。若反应后测得溶液的pH=4,则此时溶液中c( S2-)= mol·L-1。
(已知:常温时CuS、Cu(OH)2的Ksp分别为8.8×10-36、2.2×10-20)
(4)①皮革工业废水中的汞常用硫化钠除去,汞的去除率与溶液的pH和x(x代表硫化钠的实际用量与理论用量的比值)有关(如图所示)。为使除汞效果最佳,应控制的条件是:x= ,pH控制在 范围。

②某毛纺厂废水中含0.001 mol·L-1的硫化钠,与纸张漂白后的废水(含0.002 mol·L-1 NaClO)按1:2的体积比混合,能同时较好处理两种废水,处理后的废水中所含的主要阴离子有 。
(5)常温下利用Fe2+、Fe3+的相互转化,可将SO2转化为SO42-而实现SO2的处理(总反应为2SO2+O2+2H2O=2H2SO4)。已知,含SO2的废气通入含Fe2+、Fe3+的溶液时,其中一个反应的离子方程式为4Fe2+ + O2+ 4H+ =4Fe3+ + 2H2O,则另一反应的离子方程式为 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江苏省镇江市高三第一学期期末调研测试化学试卷(解析版) 题型:选择题
下列离子方程式正确的是
A.铜溶于稀硝酸:Cu+2H++NO3-=Cu2++NO2↑+H2O
B.用KIO3氧化酸性溶液中的KI:5I-+IO3-+3H2O=3I 2+6OH-
C.向NaAlO2溶液中通入过量的CO2:2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32-
D.向新制Cu(OH)2悬浊液中加入乙醛溶液并加热:CH3CHO+2Cu(OH)2+OH- CH3COO-+Cu2O↓+3H2O
CH3COO-+Cu2O↓+3H2O
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江苏省苏州市高三上学期期末调研测试化学试卷(解析版) 题型:填空题
(14分)我国某地利用生产磷铵排放的废渣磷石膏制取硫酸并联产水泥的技术研究获得成功。具体生产流程如下:
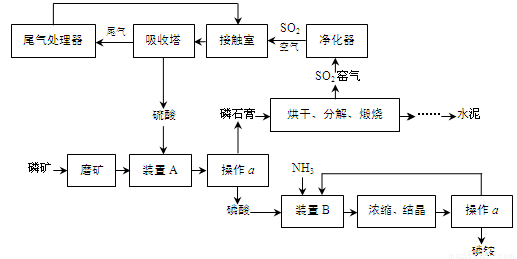
(1)操作a的名称是 。制硫酸工艺中净化SO2窑气的目的是 。
(2)装置B中生成两种酸式盐,它们的化学式分别是 。
(3)制硫酸所产生的尾气除了含有N2、O2外,还含有SO2、微量的SO3和酸雾。能用于测定硫酸尾气中SO2含量的是 。(选填字母)
A.NaOH溶液、酚酞试液 B.氨水、酚酞试液
C.碘水、淀粉溶液 D.KMnO4溶液、稀H2SO4液
(4)SO2可转化为硫酸盐。现有一种硫酸盐的化学式为Fe2(SO4)3·x(NH4)2SO4·yH2O。现称取该复盐2.410g,加入过量的NaOH溶液并加热,生成的气体用100mL 0.0500 mol·L―1硫酸吸收,多余的硫酸用0.2000 mol·L―1的NaOH溶液滴定,消耗NaOH溶液25.00mL。再将等质量的复盐溶于水配成溶液,加足量BaCl2溶液,充分反应后,过滤、洗涤、干燥,最后得白色沉淀2.330g。试列出计算过程确定该复盐的化学式。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江苏省苏州市高三上学期期末调研测试化学试卷(解析版) 题型:选择题
常温下,下列各组离子在指定溶液中一定能大量共存的是
A.在0.01 mol·L-1Ba(OH)2溶液中:Al3+、NH4+、NO3-、HCO3-
B.在加入甲基橙显红色的溶液中:Mg2+、Fe2+、Cl-、NO3-
C.在含有苯酚的溶液中:K+、NH4+、Br-、Fe3+
D.在0.01mol·L-1HCl溶液中:K+、Na+、I-、SO42-
查看答案和解析>>
科目:高中化学 来源:2014-2015学年河北省唐山市高三上学期期末理综化学试卷(解析版) 题型:实验题
(15分)对叔丁基苯酚 工业用途广泛,可用于生产油溶性酚醛树脂、稳定剂和香料等。实验室以苯酚、叔丁基氯[(CH3)3CCl]等为原料制备对叔丁基苯酚。实验步骤如下:反应物和产物的相关数据列表如下:
工业用途广泛,可用于生产油溶性酚醛树脂、稳定剂和香料等。实验室以苯酚、叔丁基氯[(CH3)3CCl]等为原料制备对叔丁基苯酚。实验步骤如下:反应物和产物的相关数据列表如下:
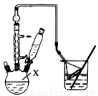
步骤l:组装仪器,用量筒量取2.2 mL叔丁基氯(过量),称取1.6 g苯酚,搅拌使苯酚完全溶解,并装入滴液漏斗。
步骤2:向X中加入少量无水AlCl3固体作催化剂,打开滴液漏斗旋塞,迅速有气体放出。
步骤3:反应缓和后,向X中加入8 mL水和1 mL浓盐酸,即有白色固体析出。
步骤4:抽滤得到白色固体,洗涤,得到粗产物,用石油醚重结晶,得对叔丁基苯酚1.8 g。
(1)仪器X的名称为 。
(2)步骤2中发生主要反应的化学方程式为 。该反应过于激烈,放出大量热,常使实验的产率降低,可能的原因是 。
(3)图中倒扣漏斗的作用是 。苯酚有腐蚀性,能使蛋白质变性,若其溶液沾到皮肤上可用 洗涤。
(4)在取用苯酚时发现苯酚冻结在试剂瓶中,可采取的措施为____ 。
(5)下列仪器在使用前必须检查是否漏液的是 (填选项字母)。
A.量筒
B.容量瓶
C.滴定管
D.分液漏斗
E.长颈漏斗
(6)本实验中,对叔丁基苯酚的产率为 。(请保留三位有效数字)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com