
下列有关说法正确的是( )
A.实验室制氢气,为了加快反应速率,可向稀H2SO4中滴加少量Cu(NO3)2溶液
B.反应A(g) 2B(g);若正反应的活化能为Ea kJ·mol-1,逆反应的活化能为Eb kJ·mol-1,则该反应的△H =(Ea -Eb)kJ·mol-1。
2B(g);若正反应的活化能为Ea kJ·mol-1,逆反应的活化能为Eb kJ·mol-1,则该反应的△H =(Ea -Eb)kJ·mol-1。
C.N2(g)+3H2(g) 2NH3(g) ΔH<0,其他条件不变时升高温度,平衡时氢气转化率增大
2NH3(g) ΔH<0,其他条件不变时升高温度,平衡时氢气转化率增大
D.吸热反应“TiO2(s)+2Cl2(g)=TiCl4(g)+O2(g)”在一定条件下可自发进行,则该反应的ΔS <0
科目:高中化学 来源:2016届江西师大附中,九江一中高三上期中化学试卷(解析版) 题型:选择题
根据表中信息判断,下列选项不正确的是( )
序号 | 反应物 | 产物 |
① | KMnO4 、H2O2 、H2SO4 | K2SO4 、MnSO4 ...... |
② | Cl2 、FeBr2 | FeCl3 、FeBr3 |
③ | MnO4- ...... | Cl2 、Mn2+ ...... |
A.第①组反应的其余产物为H2O和 O2
B.第②组反应中Cl2 与 FeBr2的物质的量之比为1︰1
C.第③组反应中生成1mol Cl2,转移电子2mol
D.氧化性由强到弱顺序为MnO4- > Cl2 > Br2 > Fe3+
查看答案和解析>>
科目:高中化学 来源:2016届福建省高三上学期期中测试化学试卷(解析版) 题型:选择题
化学在生产和日常生活中有着重要的应用。下列说法正确的是
A .汽车的排气管上装有“催化转换器”, 使有毒的CO和NO反应生成N2和CO2
B.向煤中加入适量石灰石,使煤燃烧产生的SO2最终生成CaSO3,可减少对大气的污染
C.大量燃烧化石燃料排放的废气中含CO2、SO2,从而使雨水的pH=5.6形成酸雨
D.陶瓷、水泥和光导纤维均属于硅酸盐材料
查看答案和解析>>
科目:高中化学 来源:2015-2016学年湖南常德石门第一中学高一上期中化学试卷(解析版) 题型:计算题
常温下,在35.5g水中溶解12.5g CuSO4·5H2O,恰好达到饱和,该溶液密度为1.20g /cm3,求:(1)该溶液中阴阳离子的总物质的量;
(2)该溶液中CuSO4的物质的量浓度;
查看答案和解析>>
科目:高中化学 来源:2015-2016学年湖南常德石门第一中学高一上期中化学试卷(解析版) 题型:选择题
同温同压下,等质量的下列气体所占有的体积最大的是( )
A.O2 B.CH4 C.CO2 D.SO2
查看答案和解析>>
科目:高中化学 来源:2016届湖北省高三上学期12月月考理综化学试卷(解析版) 题型:填空题
工业生产硝酸铵的流程如下图所示
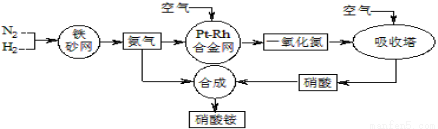
(1)硝酸铵的水溶液呈 (填“酸性”、“中性”或“碱性”);其水溶液中各离子的浓度大小顺序为: 。
(2)已知N2(g)+3H2(g) 2NH3(g) △H<0,当反应器中按n(N2):n(H2)=1:3投料,分别在200℃、400℃、600℃下达到平衡时,混合物中NH3的物质的量分数随压强的变化曲线如右图。
2NH3(g) △H<0,当反应器中按n(N2):n(H2)=1:3投料,分别在200℃、400℃、600℃下达到平衡时,混合物中NH3的物质的量分数随压强的变化曲线如右图。
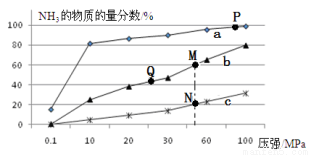
①曲线a对应的温度是 。
②关于工业合成氨的反应,下列叙述正确的是
A.及时分离出NH3可以提高H2的平衡转化率
B.P点原料气的平衡转化率接近100%,是当前工业生产工艺中采用的温度、压强条件
C.上图中M、N、Q点平衡常数K的大小关系是K(M)=K(Q)>K(N)
D.M点比N点的反应速率快
E.如果N点时c(NH3)=0.2 mol·L-1,N点的化学平衡常数K≈0.93
(3)尿素(H2NCONH2)是一种非常重要的高效氮肥,工业上以NH3、CO2为原料生产尿素,该反应实际为二步反应:
第一步:2NH3(g)+CO2(g)===H2NCOONH4(s) ΔH=-272 kJ·mol-1
第二步:H2NCOONH4(s)===CO(NH2)2(s)+H2O(g) ΔH=+138 kJ·mol-1
写出工业上以NH3、CO2为原料合成尿素的热化学方程式: ;
(4)某实验小组模拟工业上合成尿素的条件,在一体积为0.5 L密闭容器中投入4 mol氨和1mol二氧化碳,实验测得反应中各组分的物质的量随时间的变化如下左图所示:
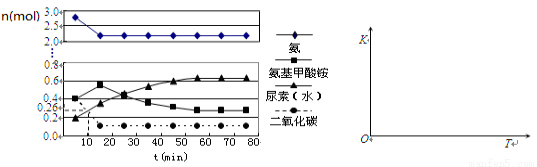
①已知总反应的快慢由慢的一步决定,则合成尿素总反应的快慢由第_____步反应决定,总反应进行到_________min时到达平衡。
②在上右图中画出第二步反应的平衡常数K随温度的变化的示意图。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年湖南常德石门第一中学高二上期中文化学卷(解析版) 题型:选择题
欲使蛋白质从溶液中析出而又不改变它的性质应加入
 A.氢氧化钠溶液 B.
A.氢氧化钠溶液 B. 饱和Na2SO4溶液 C.CuSO4溶液 D.浓硫酸
饱和Na2SO4溶液 C.CuSO4溶液 D.浓硫酸
查看答案和解析>>
科目:高中化学 来源:2015-2016学年湖南常德石门第一中学高二上期中理化学卷(解析版) 题型:选择题
已知下列反应的热化学方程式:
6C(s)+5H2(g)+3N2(g)+9O2(g)=2C3H5(ONO2)3(l) △H1
2 H2(g)+ O2(g)= 2H2O(g) △H2
C(s)+ O2(g)=CO2(g) △H3
则反应4C3H5(ONO2)3(l)=12CO2(g)+10H2O(g) +O2(g) +6N2(g)的△H为
A.12△H3+5△H2-2△H1 B.2△H1-5△H2-12△H3
C.12△H3-5△H2-2△H1 D.△H1-5△H2-12△H3
查看答案和解析>>
科目:高中化学 来源:2016届浙江省嘉兴、杭州、宁波五校高三上第一次联考化学试卷(解析版) 题型:选择题
对于反应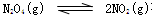 在温度一定时,平衡体系中NO2的体积分数(NO2)%随压强的变化情况如图所示(实线上的任何一点为对应压强下的平衡点),下列说法正确的是
在温度一定时,平衡体系中NO2的体积分数(NO2)%随压强的变化情况如图所示(实线上的任何一点为对应压强下的平衡点),下列说法正确的是
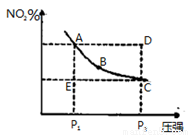
A.A、C两点的正反应速率的关系为A C
C
B.A、B、C、D、E各状态中,v(正)<v(逆)的是状态E
C.维持P1不变,E→A所需时间为x;维持P2不变,D→C所需时间为y,则x<y
D.使E状态从水平方向到达C状态后,再沿平衡曲线到达A状态,从理论上来讲,可选用的条件是从P1突然加压至P2,再由P2无限缓慢降压至P1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com