
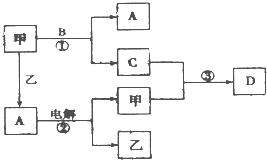
 A、B、C、D是由短周期元素组成的四种常见的化合物,D为红棕色气体,甲、乙是两种单质,这些单质和化合物之间存在如图所示的转化关系:
A、B、C、D是由短周期元素组成的四种常见的化合物,D为红棕色气体,甲、乙是两种单质,这些单质和化合物之间存在如图所示的转化关系:
| ||
| △ |
| ||
| ||
| △ |
| ||
| ||
| 2min |


 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案科目:高中化学 来源:物理教研室 题型:013
则下列叙述正确的是

( )
A. D是单质为硫
B. D是单质为氮气
C. A是单质为碳
D. A是单质为钠
查看答案和解析>>
科目:高中化学 来源: 题型:043
A、B、C、D是由三种常见的短周期元素组成的单质(一种)和化合物(三种),右图是这四种物质相互转化的关系图。并且已知:室温下,A、B为气态,C为液态,D为固态。
则下列叙述正确的是

( )
A. D是单质为硫
B. D是单质为氮气
C. A是单质为碳
D. A是单质为钠
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 A、B、C、D是由短周期元素组成的四种常见的化合物,D为红棕色气体,甲、乙是两种单质,这些单质和化合物之间存在如图所示的转化关系:
A、B、C、D是由短周期元素组成的四种常见的化合物,D为红棕色气体,甲、乙是两种单质,这些单质和化合物之间存在如图所示的转化关系:查看答案和解析>>
科目:高中化学 来源:2008-2009学年山东省滨州市高三(上)期末化学试卷(解析版) 题型:解答题
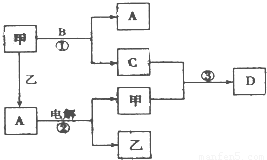
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com