
下列说法不正确的是( )
A.使用滴定管时,滴定管必须用待装液润洗2~3次
B.滴定操作中,若用待测液润洗锥形瓶,将导致测定结果偏高
C.用10 mL的量筒量取8.58 mL 0.10 mol·L-1的稀盐酸
D.稀释浓硫酸时,将浓硫酸缓缓加入水中,并不断用玻璃棒搅拌
科目:高中化学 来源:2014年高考化学苏教版总复习 9-2 食品中的有机化合物练习卷(解析版) 题型:填空题
为测定某有机化合物A的结构,进行如下实验。
【分子式的确定】
(1)将有机物A置于氧气流中充分燃烧,实验测得:生成5.4 g H2O和8.8 g CO2,消耗氧气6.72 L(标准状况下)。则该物质中各元素的原子个数比是 ;
(2)质谱仪测定该有机化合物的相对分子质量为46,则该物质的分子式是 ;
(3)根据价键理论,预测A的可能结构并写出结构简式: 。
【结构式的确定】
(4)经测定,有机物A分子内有3种氢原子,则A的结构简式为 。
【性质实验】
(5)A在一定条件下脱水可生成B,B可合成包装塑料C,请写出B转化为C的化学反应方程式: 。
(6)体育比赛中当运动员肌肉扭伤时,队医随即用氯乙烷(沸点12.27℃)对受伤部位进行局部冷冻麻醉。请用B选择合适的方法制备氯乙烷,要求原子利用率为100%,请写出制备反应的方程式: 。
(7)A可通过粮食在一定条件下制得,由粮食制得的A在一定温度下密闭储存,因为发生一系列的化学变化而变得更醇香。请写出最后一步反应的化学方程式: 。
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版总复习 8-4 难溶电解质的溶解平衡练习卷(解析版) 题型:选择题
已知Ksp(AgCl)=1.8×10-10,Ksp(AgI)=8.5×10-17。下列关于难溶物之间转化的说法中错误的是( )
A.AgCl不溶于水,不能转化为AgI
B.两种难溶物的Ksp相差越大,难溶物就越容易转化为更难溶的物质
C.AgI比AgCl更难溶于水,所以AgCl可以转化为AgI
D.常温下,AgCl若要在NaI溶液中开始转化为AgI,则NaI的浓度必须不低于6.34×10-12mol·L-1
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版总复习 8-3 盐类的水解练习卷(解析版) 题型:选择题
酸式盐NaHY的水溶液中,HY-的电离程度小于HY-的水解程度。下列有关叙述正确的是 ( )
A.HY-水解方程式为:HY-+ H2O H3O++ Y2-
H3O++ Y2-
B.在该盐的溶液中离子浓度大小关系为:c(Na+) >c(Y2-) >c(HY-) >c(OH-) >c(H+)
C.H2Y的电离方程式为:H2Y+H2O HY-+H3O+
HY-+H3O+
D.在该盐的溶液中:c(Na+) >c(HY-) >c(Y2-)>c(OH-)>c(H+)
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版总复习 8-2 溶液的酸碱性练习卷(解析版) 题型:填空题
现有浓度均为0.1 mol/L的下列溶液:
①硫酸 ②醋酸 ③氢氧化钠 ④氯化铵
请回答下列问题:
(1)①②③④四种溶液中由水电离出的H+浓度由大到小的顺序是(填序号)________。
(2)将③和④等体积混合后,混合液中各离子浓度由大到小的顺序是____。
(3)已知T ℃,KW=1×10-13,则t ℃________(填“>”、“<”或“=”)25℃。在T℃时将pH=11的NaOH溶液a L与pH=1的H2SO4溶液b L混合(忽略混合后溶液体积的变化),若所得混合溶液的pH=10,则a∶b=________。
(4)25℃时,有pH=x的盐酸和pH=y的氢氧化钠溶液(x≤6,y≥8),取a L该盐酸与b L该氢氧化钠溶液反应,恰好完全中和,求:
①若x+y=14,则a/b=________(填数据);
②若x+y=13,则a/b=________(填数据);
③若x+y>14,则a/b=________(填表达式);
④该盐酸与该氢氧化钠溶液完全中和,两溶液的pH(x、y)的关系式为__(填表达式)。
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版总复习 8-2 溶液的酸碱性练习卷(解析版) 题型:选择题
向含有H2SO4的CuSO4溶液中逐滴加入含a mol溶质的NaOH溶液,恰好使溶液的pH=7,下列叙述错误的是( )
A.反应后溶液中c(Na+)=2c(SO42—)
B.a/2mol>沉淀的物质的量>0
C.沉淀的质量=49a g
D.溶液中n(SO42—)=a/2 mol
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版总复习 8-1 弱电解质的电离平衡练习卷(解析版) 题型:填空题
用实验确定某酸HA是弱电解质。甲、乙两同学的方案是:
甲:①称取一定质量的HA配制0.1 mol/L的HA溶液100 mL;②用pH试纸测出该溶液的pH,即能证明HA是弱电解质。
乙:①用已知物质的量浓度的HA溶液、盐酸,分别配制pH=1的两种酸溶液各100 mL;②分别取这两种溶液各10 mL,加水稀释至100 ml;③各取相同体积的两种稀释液装入两个试管中,同时加入纯度相同的锌粒,观察现象,即可证明HA是弱电解质。
(1)甲方案中,说明HA是弱电解质的理由是测得溶液的pH________1(填“>”“<”或“=”),乙方案中,说明HA是弱电解质的现象是________(填序号)。
a.装盐酸的试管中放出H2的速率快
b.装HA溶液的试管中放出H2的速率快
c.两个试管中产生气体的速率一样快
(2)请你评价乙方案中难以实现之处和不妥之处________。
(3)请你再提出一个合理而比较容易进行的方案(药品可任用),请表述实验方案:________。
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版总复习 7-3 化学平衡的移动练习卷(解析版) 题型:选择题
在一定温度下,将等量的气体分别通入起始体积相同的密闭容器Ⅰ(恒容)和Ⅱ(恒压)中,使其发生反应,t0时容器Ⅰ中达到化学平衡,X、Y、Z的物质的量与时间的变化关系如图所示,则下列有关推断正确的是 ( )

A.该反应的化学方程式:3X+2Y 3Z
3Z
B.若两容器中均达到平衡后,两容器的体积V(Ⅰ)<V(Ⅱ),则容器Ⅱ达到平衡所用时间小于t0
C.若两容器中均达到平衡后,两容器中Z的物质的量分数相同,则Y为固态或液态
D.达平衡后,若对容器Ⅱ升高温度时其体积增大,说明Z发生的反应为吸热反应
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版总复习 7-1 化学反应速率练习卷(解析版) 题型:选择题
合成氨反应:N2(g)+3H2(g) 2NH3(g);ΔH=-92.4 kJ·mol-1,在反应过程中,正反应速率的变化如下图:
2NH3(g);ΔH=-92.4 kJ·mol-1,在反应过程中,正反应速率的变化如下图:
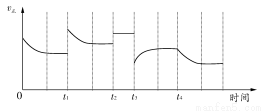
下列说法正确的是( )
A.t1时升高了温度 B.t2时使用了催化剂
C.t3时增大了压强 D.t4时降低了温度
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com