
分析 (1)氯化铵受热分解生成氨气和氯化氢,破坏的化学键为离子键和共价键;石墨转化为金刚石,生成新物质是化学变化;能越低越稳定,石墨比金刚石稳定,所以石墨能量低于金刚石,根据能量守恒低能到高能要吸热;
(2)原电池是将化学能转化为电能;铝是活泼金属,易被氧化而失去电子,发生氧化反应,应做原电池的负极,电极反应式为Al-3e-=Al3+,所以正极材料是铂铁合金,正极上氧气得电子发生还原反应:O2+2H2O+4e-=4OH-,阴离子向负极移动;
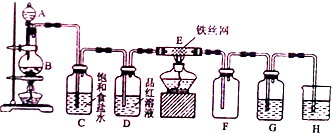
(3)①仪器A的名称是分液漏斗;B中的物质与浓盐酸发生氧化还原反应生成氯气,浓盐酸具有还原性,所以B中的物质具有氧化性;二氧化锰与浓盐酸在加热条件下反应生成氯化锰、氯气和水,注意浓盐酸在离子方程式中应该写成离子形式;
②防止生成的氯化铁接触到水,所以装置G中的试剂为浓硫酸;氯水具有漂白性,所以装置D中的现象为品红溶液褪色,装置H是氢氧化钠溶液,其作用是吸收多余的氯气;
③装置E中发生铁与氯气反应生成氯化铁,反应的化学方程式为:2Fe+3Cl2$\frac{\underline{\;\;△\;\;}}{\;}$2FeCl3,左边应加干燥的装置.
解答 解:(1)氯化铵受热分解生成氨气和氯化氢,破坏的化学键为离子键和共价键;石墨转化为金刚石,生成新物质是化学变化;能越低越稳定,石墨比金刚石稳定,所以石墨能量低于金刚石,根据能量守恒低能到高能要吸热;故答案为:共价键、离子键;化学;吸热;
(2)原电池是将化学能转化为电能;铝是活泼金属,易被氧化而失去电子,发生氧化反应,应做原电池的负极,电极反应式为Al-3e-=Al3+,所以正极材料是铂铁合金,正极上氧气得电子发生还原反应:O2+2H2O+4e-=4OH-,阴离子向负极移动,故答案为:将化学能转化为电能;铂铁合金;发生氧化反应;负极;
(3)①仪器A的名称是分液漏斗;B中的物质与浓盐酸发生氧化还原反应生成氯气,浓盐酸具有还原性,所以B中的物质具有氧化性;二氧化锰与浓盐酸在加热条件下反应生成氯气,反应的离子方程式为:MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O,
故答案为:分液漏斗;氧化性;MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O;
②防止生成的氯化铁接触到水,所以装置G中的试剂为浓硫酸;氯水具有漂白性,所以装置D中的现象为品红溶液褪色,装置H是氢氧化钠溶液,其作用是吸收多余的氯气,故答案为:浓硫酸;品红溶液褪色;吸收多余的氯气;
③装置E中发生铁与氯气反应生成氯化铁,反应的化学方程式为:2Fe+3Cl2$\frac{\underline{\;\;△\;\;}}{\;}$2FeCl3,在装置D和E之间添加一个干燥的装置,故答案为:2Fe+3Cl2$\frac{\underline{\;\;△\;\;}}{\;}$2FeCl3;在装置D和E之间添加一个干燥的装置.
点评 本题考查电化学和学生对性质实验方案设计题的掌握,难度大,需要学生具有扎实的基础知识与灵活运用知识解决问题的能力.


科目:高中化学 来源: 题型:解答题
| 儿童牙膏 | 防臭牙膏 | 透明牙膏 | |
| 摩擦剂 | 氢氧化铝 | 碳酸钙 | 氧化硅 |
| 物质类别 | 碱 | 盐 | 氧化物 |
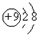 ,请写出氟化钠在水溶液中的电离方程式NaF=Na++F-.
,请写出氟化钠在水溶液中的电离方程式NaF=Na++F-.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化学平衡常数是指在一定温度下生成物浓度幂之积与反应物浓度幂之积的比值 | |
| B. | 勒夏特列原理指的是,如果改变影响平衡的条件之一(如温度、压强、参与反应物质的浓度,),平衡将向着能够减弱这种改变的方向移动 | |
| C. | 盐溶液不一定呈中性,不显中性的盐都会促进水的电离 | |
| D. | 把被保护的钢铁设备作为电解池的阴极,该方法称为牺牲阳极的阴极保护法 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
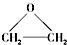 ),该反应的原子利用率为100%,反应的化学方程式为2CH2=CH2+O2$\stackrel{加热}{→}$
),该反应的原子利用率为100%,反应的化学方程式为2CH2=CH2+O2$\stackrel{加热}{→}$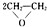 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 人造纤维、合成纤维和碳纤维都是有机高分子化合物 | |
| B. | 加热能杀死流感病毒是因为病毒的蛋白质受热变性 | |
| C. | 煤的干馏和石油的分馏均属于化学变化 | |
| D. | 油脂都不能使溴的四氯化碳溶液褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 分子发生化学变化时,会生成新的分子,但不会分裂成原子 | |
| B. | 2molH2和1molO2完全反应,结果放出930kJ的热量 | |
| C. | 1molH-H和$\frac{1}{2}$molO-O键的断裂过程共放出930KJ的热量 | |
| D. | 分析变化的全过程,可得出形成H-O键将放出能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A | B | C | D | |
| 反应物 | CO2 | Fe2O3 | C2H5OH | FeCl3 |
| 生成物 | MgO | Al2O3 | C2H5ONa | CuCl2 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分子组成相差一个或若干个CH2原子团的化合物一定互为同系物 | |
| B. | 互为同分异构体的有机物的组成元素相同,但结构必须不同 | |
| C. | 分子式为C3H8与C6H14的两种有机物一定互为同系物 | |
| D. | 互为同系物的有机物其相对分子质量数值一定相差14n(n为正整数) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com