
下列各组离子一定能大量共存的是
A.某无色透明的酸性溶液:Cl-、Na+、MnO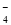 、
、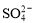
B.能使pH试纸变深蓝色的溶液:Na+、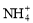 、K+、
、K+、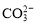
C.加入过量NaOH溶液后可得到澄清的溶液:K+、Ba2+、HCO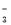 、Cl-
、Cl-
D.常温下PH=12的溶液:K+、Ba2+、Cl-、NO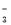
科目:高中化学 来源:2015届北京理工附中高三第一次月考化学试卷(解析版) 题型:填空题
(10分)X,Y,Z为三个不同短周期非金属元素的单质。在一定条件下有如下反应:Y+X→A(g),Y+Z→B(g)。请针对以下两种不同情况回答:
(1)若常温下X,Y,Z均为气体,A的相对分子质量大于B,且A和B化合生成固体C时有白烟产生,则:①C的电子式是__________;②B溶于水的过程中存在的可逆反应式为___________________________。
(2)若常温下Y为固体,X,Z为气体,A在空气中充分燃烧可生成B,则:①A的化学式是_________;②向苛性钠溶液中通入过量的B,所发生反应的离子方程式是_______________________。③若A的燃烧热为M kJ·mol-1,试写出该反应的热化学方程式_____________________
查看答案和解析>>
科目:高中化学 来源:2015届北京市高三上学期第一次月考化学试卷(解析版) 题型:选择题
已知四种盐的溶解度(S)曲线如右图所示,下列说法不正确的是

A.将NaCl溶液蒸干可得NaCl固体
B.将MgCl2溶液蒸干可得MgCl2固体
C.可用MgCl2和NaClO3制备Mg(ClO3)2
D.Mg(ClO3)2中混有少量NaCl杂质,可用重结晶法提纯
查看答案和解析>>
科目:高中化学 来源:2015届北京市高三上学期第一次质量检测化学试卷(解析版) 题型:选择题
下列关于实验现象的描述不正确的是
A.把铜片和铁片紧靠在一起浸入稀硫酸中,铜片表面出现气泡
B.用锌片做阳极,铁片做阴极,电解氯化锌溶液,铁片表面出现一层锌
C.把铜片插入三氯化铁溶液中,在铜片表面出现一层铁
D.把锌粒放入盛有盐酸的试管中,加入几滴氯化铜溶液,气泡放出速率加快
查看答案和解析>>
科目:高中化学 来源:2015届北京市高三上学期第一次质量检测化学试卷(解析版) 题型:选择题
下列分类说法正确的是:
A.纯碱属于碱
B.苯酚属于芳香烃
C.铝热反应属于氧化还原反应
D.甲酸能发生银镜反应故属于醛
查看答案和解析>>
科目:高中化学 来源:2015届北京市高三上学期第一次质量检测化学试卷(解析版) 题型:选择题
用一种试剂将NaCl、MgCl2、AlCl3、(NH4)2SO4四种无色溶液鉴别出来,该试剂是
A.Na2CO3溶液 B.AgNO3溶液
C.NaOH溶液 D.BaCl2溶液
查看答案和解析>>
科目:高中化学 来源:2015届北京市朝阳区高三年级第一学期期中统一考试化学试卷(解析版) 题型:填空题
(9分)合成氨对农业生产及国防建设均具有重要意义。
N2(g)+3H2(g)  2NH3(g) △H = -92 kJ·mol-1
2NH3(g) △H = -92 kJ·mol-1
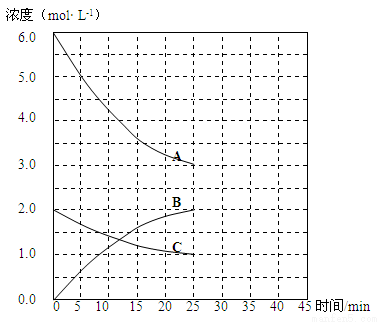
T1℃时,在恒温恒容的密闭容器中,合成氨反应的各物质浓度变化曲线如下图所示:
请回答:
(1)若反应起始时n(N2)为1mol、n(H2)为3mol,则反应达到平衡时,放出的热量 (填“=”或“<”或“>”)92 kJ
(2)表示N2 浓度变化的曲线是 (填浓度变化曲线代号“A”或“B”或“C”)。
(3)用H2 浓度的变化表示该反应在0~25min末的速率是 mol·L-1·min-1。
(4)若该反应在一定条件下于25 min末达到平衡状态,则
①此时平衡常数K = 。
②保持该反应条件不变至第30 min末,将温度由T1℃升高到T2℃,则反应在第40min末再次达到平衡,在此过程中H2浓度变化了1.5 mol·L-1,请在图中画出从第25 min末 ~ 45min末NH3浓度的变化曲线。
查看答案和解析>>
科目:高中化学 来源:2015届北京市朝阳区高三年级第一学期期中统一考试化学试卷(解析版) 题型:选择题
下列说法正确的是
①通过丁达尔效应可以鉴别稀豆浆和Fe(OH)3胶体
②常温时,FeCl3溶液中Fe3+与Cl-的个数之比等于1:3
③化学方程式Br2 + 2KI = 2KBr + I2说明Br的非金属性强于I
④常温时,0.1 mol·L-1 盐酸中由水电离出的c(H+)<10-7mol·L-1
A.①② B.③④ C.①③ D.②④
查看答案和解析>>
科目:高中化学 来源:2015届内蒙古赤峰市高三上学期9月质量检测化学试卷(解析版) 题型:填空题
(8分)1808年,英国化学家用钾还原氧化镁,最早制得少量的镁。镁是航空工业的重要材料,镁作为一种强还原剂,还用于钛、铍和铀的生产中。
(1)镁在元素周期表中的位置为 。
(2)写出用镁与金红石(主要成分为TiO2)在加热条件下制取钛的化学方程式:
。
(3)镁在加热的条件下还能与NaOH固体反应,生成MgO和单质X、单质Y。已知X与水反应可生成单质Y,则镁与NaOH反应的化学方程式为: 。
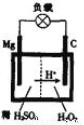
(4)镁一过氧化氢电池的工作原理如图所示,该电池放电时总反应的化
学方程式为:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com