
分析 (1)根据v=$\frac{△c}{△t}$计算二氧化氮的速率,再根据速率之比=计量数之比计算四氧化二氮的速率;
(2)根据n=cV计算4s时NO2的物质的量,结合方程式计算参加反应四氧化二氮的物质的量,进而计算4s时混合气体总物质的量,恒温恒容下,气体压强之比等于其物质的量之比;
(3)恒温恒容下,气体压强之比等于其物质的量之比,据此计算平衡时混合气体总物质的量,根据方程式利用差量法计算消耗的N2O4的物质的量,进而计算NO2的平衡浓度.
解答 解:(1)4s时NO2的浓度为0.04mol/L,则v(NO2)=$\frac{0.04mol/L}{4s}$=0.01mol•L-1•s-1,v(N2O4)=$\frac{1}{2}$×0.01mol•L-1•s-1=0.005mol•L-1•s-1;
故答案为:0.005 mol•L-1•s-1
(2)4s时NO2的物质的量为10L×0.04mol/L=0.4mol,则参加反应N2O4的物质的量为0.4mol×$\frac{1}{2}$=0.2mol,故4s时混合气体总物质的量为(1mol-0.2mol)+0.4mol=1.2mol,恒温恒容下,气体压强之比等于其物质的量之比,故4s时容器内的压强为开始时的$\frac{1.2mol}{1mol}$=1.2倍;
故答案为:1.2;
(3)恒温恒容下,气体压强之比等于其物质的量之比,则平衡时混合气体总物质的量为1mol×1.8=1.8mol,则:
N2O4?2NO2 △n
1mol 1mol
0.8mol←1.8mol-1mol=0.8mol
则参与反应的四氧化二氮为0.8mol,生成的N2O4为1.6mol,平衡时容器内NO2的浓度是$\frac{1.6mol}{10L}$=0.16 mol•L-1;
故答案为:0.16 mol•L-1.
点评 本题考查化学反应速率计算、化学平衡有关计算,基础性强,难度不大,有利于基础知识的巩固.注意计算准确.


 金钥匙试卷系列答案
金钥匙试卷系列答案科目:高中化学 来源: 题型:选择题
| A. | Cu+2FeCl3═CuCl2+2FeCl2 | |
| B. | 2NaHCO3 $\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2↑ | |
| C. | Cl2+2KI═2KCl+I2 | |
| D. | 2CuSO4+2H2O $\frac{\underline{\;通电\;}}{\;}$2Cu+2H2SO4+O2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 浊液a中存在沉淀溶解平衡:AgCl(s)?Ag+(aq)+Cl-(aq) | |
| B. | 滤液b中不含有Ag+ | |
| C. | ③中颜色变化说明AgCl转化为AgI | |
| D. | 实验可以证明AgI比AgCl更难溶 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| t/s | 0 | 50 | 150 | 250 | 350 |
| n(PCl3)/mol | 0 | 0.16 | 0.19 | 0.20 | 0.20 |
| A. | 反应在前50 s的平均速率为v(PCl3)=0.0016mol•L-1•s-1 | |
| B. | 保持其他条件不变,升高温度,平衡时,c(PCl3)=0.11mol•L-1,则反应的△H>0 | |
| C. | 相同温度下,起始时向容器中充入1.0 molPCl5、0.20 molPCl3和0.20 molCl2,达到平衡前v(正)>v(逆) | |
| D. | 相同温度下,起始时向容器中充入2.0 molPCl3、2.0 molCl2,达到平衡时,PCl3的转化率小于80% |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某温度时,在2L的密闭容器中,X、Y、Z三种物质的量随时间的变化曲线如图所示.
某温度时,在2L的密闭容器中,X、Y、Z三种物质的量随时间的变化曲线如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:推断题
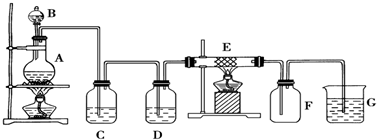
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
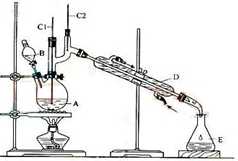 正丁醛是一种化工原料.某实验小组利用如图装置合成正丁醛.
正丁醛是一种化工原料.某实验小组利用如图装置合成正丁醛.| 沸点/℃ | 密度/(g•cm-3) | 水中溶解性 | |
| 正丁醇 | 117.72 | 0.8109 | 微溶 |
| 正丁醛 | 75.7 | 0.8017 | 微溶 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com