
下列溶液中微粒的物质的量浓度关系正确的是
A.室温下,向0.01mol/L NH4HSO4溶液中滴加NaOH溶液至中性:c(Na+)>c(NH4+)>c(SO42-)>c(OH-)=c(H+)
B.0.1 mol/L NaHCO3溶液:c(Na+)>c(HCO3-)>c(OH-)>c(H+)
C.Na2CO3溶液:c(OH-)-c(H+)=c(HCO3-)+2c(H2CO3)
D.25 ℃时,pH=4.75、浓度均为0.1 mol/L的CH3COOH、CH3COONa混合溶液:c(CH3COO-)+c(OH-)<c(CH3COOH)+c(H+)
B、C
【解析】
试题分析:A.室温下,向0.01mol/L NH4HSO4溶液中滴加NaOH溶液至中性,若恰好中和盐电离产生的H+,则c(Na+) =c(SO42-) =c(NH4+)。但是由于NH4+水解会使溶液显酸性,因此NaOH要稍微过量,则溶液中离子浓度关系是:c(Na+) >c(SO42-) >c(NH4+)>c(OH-)=c(H+),错误;B.0.1 mol/L NaHCO3溶液,根据物料守恒可得:c(Na+)>c(HCO3-),HCO3-水解消耗水电离产生的H+,最终溶液显碱性,所以c(OH-)>c(H+)。盐的水解程度是微弱的。盐电离产生的离子浓度远大于水电离产生的离子浓度,所以c(HCO3-)>c(OH-)。故离子浓度关系是:c(Na+)>c(H CO3-)>c(OH-)>c(H+),正确。C.Na2CO3溶液中存在水的电离平衡:H2O H++OH-,同时还存在CO32-、HCO3-的水解平衡,水解消耗H+使溶液显碱性。c(OH-)-c(H+)就是盐电离产生的离子的水解产生的c(OH-)。c(HCO3-)+2c(H2CO3)就是CO32-水解产生HCO3-、H2CO3的c(OH-)的浓度。因此二者相等,故c(OH-)-c(H+)=c(HCO3-)+2c(H2CO3),正确;D.25 ℃时,pH=4.75、浓度均为0.1 mol/L的CH3COOH、CH3COONa混合溶液:说明在该溶液中CH3COO-的水解作用小于CH3COOH 的电离作用。在溶液中还存在水的电离平衡,所以离子浓度:c(H+)- c(OH-)> c(CH3COOH)-c(CH3COO-)。故c(CH3COO-)-c(OH-)>c(CH3COOH)-c(H+),错误。
H++OH-,同时还存在CO32-、HCO3-的水解平衡,水解消耗H+使溶液显碱性。c(OH-)-c(H+)就是盐电离产生的离子的水解产生的c(OH-)。c(HCO3-)+2c(H2CO3)就是CO32-水解产生HCO3-、H2CO3的c(OH-)的浓度。因此二者相等,故c(OH-)-c(H+)=c(HCO3-)+2c(H2CO3),正确;D.25 ℃时,pH=4.75、浓度均为0.1 mol/L的CH3COOH、CH3COONa混合溶液:说明在该溶液中CH3COO-的水解作用小于CH3COOH 的电离作用。在溶液中还存在水的电离平衡,所以离子浓度:c(H+)- c(OH-)> c(CH3COOH)-c(CH3COO-)。故c(CH3COO-)-c(OH-)>c(CH3COOH)-c(H+),错误。
考点:考查溶液中微粒的浓度的大小比较的知识。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:单选题
加强食品检测是保证食品安全、保护公众利益的重要举措,下列物质不属于食品安全检测范畴的是 ( )
| A.三聚氰胺 | B.苏丹红 | C.亚硝酸钠 | D.葡萄糖 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
各种洗涤剂广泛进入人们的生活中,下列洗涤中所用洗涤剂具有乳化功能的是
| A.用汽油除去衣服上的油污 |
| B.用餐具洗洁精清洗餐具上的油污 |
| C.用水洗去盘子中的水果渣 |
| D.用醋洗去水壶的水垢 |
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江苏省高三上学期期中考试化学试卷(解析版) 题型:填空题
(15分)草酸镍晶体(NiC2O4?2H2O)可用于制镍催化剂,硫酸镍晶体(NiSO4?7H2O)主要用于电镀工业。某小组用废镍催化剂(成分为Al2O3、Ni、Fe、SiO2、CaO等)制备草酸镍晶体的部分实验流程如下:
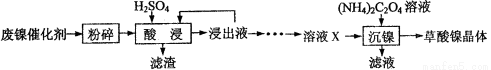
已知:①相关金属离子生成氢氧化物沉淀的pH如下表(开始沉淀的pH按金属离子浓度为1.0 mol?L-1计算):

②Ksp(CaF2)= 1.46×10-10 Ksp(CaC2O4)= 2.34×10-9
(1)粉碎的目的是 。
(2)保持其他条件相同,在不同温度下对废镍催化剂进行“酸浸”,镍浸出率随时间变化如图
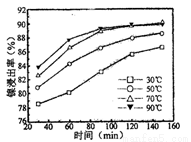
“酸浸”的适宜温度与时间分别为 (填字母)。
A.30℃、30min B.90℃、150min
C.70℃、120min D.90℃、120min
(3)证明“沉镍”工序中Ni2+已经沉淀完全的实验步骤及现象是 。
(4)将“沉镍”工序得到的混合物过滤,所得固体用乙醇洗涤、110℃下烘干,得草酸晶体。
①用乙醇洗涤的目的是 ;
②烘干温度不超过110℃的原因是 。
(5)由流程中的“浸出液”制备硫酸镍晶体的相关实验步骤如下:
第1步:取“浸出液”, ,充分反应后过滤,以除去铁、铝元素;
第2步:向所得滤液中加入适量NH4F溶液,充分反应后过滤,得“溶液X”;
第3步: ,充分反应后过滤;
第4步:滤渣用稍过量硫酸充分溶解后,蒸发浓缩、冷却结晶、过滤、洗涤、干燥,得硫酸镍晶体。
①请补充完整相关实验步骤(可选试剂:H2SO4溶液、NaOH溶液、HNO3溶液、H2O2溶液)
②第2步中加入适量NH4F溶液的作用是 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江苏省高三上学期期中考试化学试卷(解析版) 题型:选择题
下表为部分短周期元素的原子半径及主要化合价。下列说法正确的是
元素符号 | L | M | Q | R | T |
原子半径 | 0.186 | 0.143 | 0.104 | 0.075 | 0.066 |
主要化合价 | +1 | +3 | +6、-2 | +5、-3 | -2 |
A.气态氢化物的稳定性:R>T
B.工业上电解MCl3溶液制备单质M
C.化合物L2T与QT2所含化学键类型相同
D.L与Q的最高价氧化物的水化物均能与M(OH)3反应
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江苏省高三上学期期中考试化学试卷(解析版) 题型:选择题
下列有关化学用语正确的是
A.明矾的化学式:KAl(SO4)2
B.氯离子的结构示意图: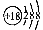
C.2-丙醇的结构简式:(CH3)2CHOH
D.溴化铵的电子式: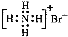
查看答案和解析>>
科目:高中化学 来源:2014-2015陕西省宝鸡市高二上学期期末化学试卷(解析版) 题型:选择题
设NA为阿伏伽德罗常数的值,下列叙述错误的是
A.通常情况下,87 g丙酮分子中含有的π键键数为1.5 NA
B.标准状况下,11.2 L三氯甲烷分子中含有的σ键键数为2 NA
C.2.5 mol乙醛与足量的氢气完全加成,断裂的π键键数为2.5 NA
D.15 g 氨基乙酸通过成肽反应全部生成二肽时,生成的肽键键数为0.1 NA
查看答案和解析>>
科目:高中化学 来源:2014-2015山东省潍坊市高一上学期1月月考化学试卷(解析版) 题型:选择题
在常温下发生以下几个反应:①16H++10Z-+2XO4-=2X2+ + 5Z2+8H2O
②2A2+ + 5B2=2A3++2B- ③2B-+ Z2 =B2+2Z-
根据上述反应,判断下列结论错误的是
A.溶液中可发生:Z2+2A2+=2A3++2Z- B.Z2在①③反应中为氧化剂
C.氧化强弱顺序为:XO4-> Z2> B2> A3+ D.X2+是XO4-的还原产物
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com