
某中学课外兴趣小组用惰性电极电解饱和食盐水(含少量Mg2+)作系列探究,装置如图所示:
(1)电解时,甲同学发现电极a附近溶液出现浑浊,请用离子方程式表示原因:
___________________________________________________________________________________。
(2)一段时间后,你认为C中溶液可能出现的现象是_________________________________,请用离
子方程式表示原因______________________________________________________。
(3)随着反应的进行,兴趣小组的同学们都特别注意到D中溶液红色逐渐褪去。他们对溶液红色褪去主要原因提出了如下假设,请你完成假设二。
假设一:B中逸出气体与水反应生成的物质有强氧化性,使红色逐渐褪去;
假设二:______________________________________________________________________。
(4)请你设计实验验证上述假设一,写出实验步骤及结论:_____________________________________。
(1)2H2O+2e- = 2OH-+H2↑,Mg2++2OH-=Mg(OH)2↓(共2分,每个1分。若写成水电离、再H+得电子生成氢气和OH-与Mg2+反应生成沉淀的过程,也给分)
(2)有淡黄色沉淀(1分); Cl2+S2-=2Cl-+S↓(2分)
(3)可能是H+中和了OH-而褪色。(1分)
(4)取少量D中褪色后的溶液于试管中,加入稍过量的NaOH溶液,若不变红,则假设一正确。(2分,其它合理答案也可以)
解析试题分析:(1)根据装置图可知,电极a与电源的负极相连,作阴极,溶液中的氢离子放电。随着氢离子的放电,a电极附近水的电离被促进,从而导致a电极负极溶液中OH-浓度增大。又因为溶液中含有镁离子,因此会产生氢氧化镁白色沉淀,有关的电极反应式为2H++2e-= H2↑、Mg2++2OH-=Mg(OH)2↓。
(2)b电极与电源的正极相连,作阳极,溶液中的氯离子放电生成氯气。氯气具有强氧化性,能把硫离子氧化生成单质S沉淀,从而使溶液变混浊,因此C中溶液可能出现的现象是有淡黄色沉淀,反应的离子方程式为Cl2+S2-==2Cl-+S↓。
(3)由于氯气溶于水生成次氯酸和盐酸,溶液显酸性,因此褪色的原因也可能是H+中和了OH-而褪色。
(4)由于次氯酸的氧化而褪色是不可逆的,即向褪色后的溶液中再滴加氢氧化钠溶液,则不会恢复用来的颜色,据此可以验证。因此正确的操作是取少量D中褪色后的溶液于试管中,加入稍过量的NaOH溶液,若不变红,则假设一正确。
考点:考查电解原理的有关判断、氯气性质以及实验设计方案等


科目:高中化学 来源: 题型:填空题
电解原理在化学工业中有广泛的应用。如图表示一个电解池, 装有电解液a;X、Y是两块电极板,通过导线与直流电源相连。
请回答以下问题:
(1)若X、Y都是惰性电极,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞试液,则:
①电解池中X极上的电极反应式为 ,在X极附近观察到的现象是 。电解液中向X极方向移动的离子是 。
②Y电极上的电极反应式为 ,
(2)如要用电解方法精炼粗铜,电解液a选用CuSO4溶液,则:
①X电极的材料是
②Y电极的电极反应式为 (说明:杂质发生的反应不必写出。)
③溶液中的c(Cu2+)与电解前相比 (填“变大”、“变小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
某化学兴趣小组用下图装置电解CuSO4溶液,测定铜的相对分子质量。
(1)若实验中测定在标准状况下放出的氧气的体积VL,A连接直流电源的__________ (填“正极”或“负极”)。
(2)电解开始一段时间后,在U形管中可观察到的现象-____________________________。
电解的离子方程式为 。
(3)实验中还需测定的数据是_______________(填写序号)。
①A极的质量增重m g ②B极的质量增重m g
(4)下列实验操作中必要的是____________(填字母)。
| A.称量电解前电极的质量 |
| B.电解后,电极在烘干称重前,必须用蒸馏水冲洗 |
| C.刮下电解过程中电极上析出的铜,并清洗、称重 |
| D.电极在烘干称重的操作中必须按“烘干—称重一再烘干一再称重”进行 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
根据铜锌原电池示意图,回答下列问题:
(1)锌为 极,电极反应式为 ;铜为 极,电极反应 为 ,原电池总离子反应式是 。
(2)若以该电池作为电源,以石墨碳棒为电极电解CuCl2溶液,在电池的工作过程中,Zn极质量变化了3.25g,则Cu极质量 (填“增加”、“不变”或“减少”);电子从电池的锌极沿导线流向电解池的 (填“阴极”或“阳极”,下同);在电解池中Cu2+向 移动,在该电极上析出铜的质量为 g。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
某水溶液中含有等物质的量浓度的Cu(NO3)2和MgCl2,对该溶液以惰性电极进行电解,分阶段写出电解反应的化学方程式。
第一阶段的反应:______________________________________________________________________;
第二阶段的反应:______________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
如何防止铁的锈蚀是工业上研究的重点内容。为研究铁的锈蚀,如下图所示,铁处于①、②、③三种不同的环境中。请回答:
(1)金属腐蚀主要分为 腐蚀和 腐蚀两种。
(2)铁被腐蚀的速率由快到慢的顺序是 (填序号)。
(3)②中正极的电极反应式为 ,
负极的电极反应式为 ,
③中负极的电极反应式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
工业上以锂辉石(Li2O·A12O3·4SiO2,含少量Ca、Mg元素)为原料生产碳酸锂。其部分工艺流程如下: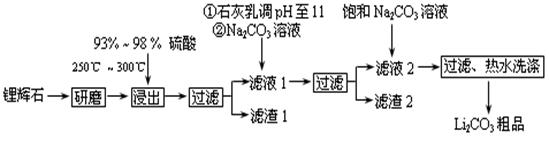
已知:①Li2O·Al2O3·4SiO2 + H2SO4(浓) Li2SO4 + Al2O3·4SiO2·H2O↓
Li2SO4 + Al2O3·4SiO2·H2O↓
| T/℃ | 20 | 40 | 60 | 80 |
| S(Li2CO3)/g | 1.33 | 1.17 | 1.01 | 0.85 |
| S(Li2SO4)/g | 34.2 | 32.8 | 31.9 | 30.7 |

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(1)如下图所示,组成一种原电池.试回答下列问题(灯泡功率合适):
①电解质溶液为稀H2SO4时上述装置中灯泡亮,此时Al电极上发生反应的电极反应式为: ___ ;
②电解质溶液为NaOH溶液时,灯泡__________(填“亮”或“不亮”, 填“亮”做a题,填“不亮”做b题)。
a.若灯泡亮,则Al电极上发生反应的电极反应式为:_______________ ;
b.若灯泡不亮,其理由为:________________________ 。
(2)原电池原理的应用之一是可以设计原电池。请利用反应“Cu+2Fe3+ =2Fe2+ +Cu2+ ”设制一个原电池(正极材料用碳棒)则该电池的负极材料是 ,正极上发生反应的电极反应式 ;若导线上转移电子1.5 mol,则溶解铜的质量是 。另外的重要应用是实验室在用锌与稀硫酸反应制备氢气时,可向溶液中滴加少量硫酸铜溶液,其作用是: 。
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
有一硝酸盐晶体,其化学式为M(NO3)x·yH2O,相对分子质量为242。取1.21g该晶体溶于水,配成100mL溶液,将此溶液用石墨作电极进行电解,当有0.01mol电子发生转移时,溶液中金属恰好全部析出,经称量阴极增重0.32g。求:
(1)金属M的相对原子质量及x、y。
(2)电解后溶液的pH(电解过程中溶液体积变化忽略不计)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com