
【题目】已知NA是阿伏加德罗常数的值,下列说法正确的是( )
A.1L0.1molL-1H2C2O4溶液中含C2O![]() 离子数为0.1NA
离子数为0.1NA
B.2molNO与2molO2在密闭容器中充分反应,转移的电子数为8NA
C.32gS8与S6(![]() )的混合物中所含共价键数目为NA
)的混合物中所含共价键数目为NA
D.标准状况下22.4L氯气与甲烷的混合气体,光照时充分反应生成HCl分子数为NA
【答案】C
【解析】
A.草酸为弱酸,在溶液中不能完全电离,所以该溶液中含C2O![]() 离子数小于0.1NA,故A错误;
离子数小于0.1NA,故A错误;
B.2molNO与2molO2在密闭容器中充分反应方程式为2NO+O2=2NO2,氧气过量,NO完全反应,NO反应化合价升高2价,故2molNO完全反应转移电子为4NA个,故B错误;
C.S8与S6中分别含8条和6条共价键,即1mol硫原子形成1mol共价键,而32gS8与S6的混合物中含硫为1mol,则该混合物中含NA个S-S键,故C正确;
D.在标准状况下,22.4L氯气与甲烷混合气体,光照时充分反应,由于无法知道氯气、甲烷各为多少,所以生成HCl分子数无法计算,故D错误;
故答案为C。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】NA是阿伏加德罗常数的值,下列说法正确的是
A.16.25g FeCl3水解形成的Fe(OH)3胶体粒子数为0.1NA
B.92.0g 甘油(丙三醇)中含有羟基数为1.0NA
C.22.4L(标准状况)氩气含有的质子数为18NA
D.1.0mol CH4与Cl2在光照下反应生成的CH3Cl分子数为1.0NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】抗癌药托瑞米芬的前体K的合成路线如图。
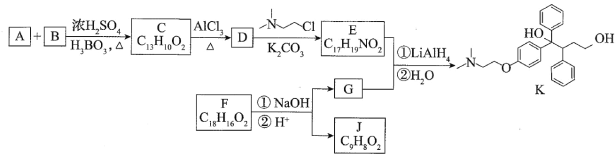
已知:
ⅰ.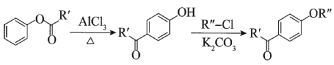 ;
;
ⅱ.有机物结构可用键线式表示,如(CH3)2NCH2CH3的键线式为![]() 。
。
(1)有机物A能与Na2CO3溶液反应产生CO2,其钠盐可用于食品防腐。有机物B能与Na2CO3溶液反应,但不产生CO2;B加氢可得环己醇。A和B反应生成C的化学方程式是_______。
(2)D中含有的官能团名称:_______。
(3)E的结构简式为_______。
(4)F是一种天然香料,经碱性水解、酸化,得G和J。J经还原可转化为G。J的结构简式为_______。
(5)M是J的同分异构体,符合下列条件的M的结构简式是_______。
①包含2个六元环
②M可水解,与NaOH溶液共热时,1molM最多消耗2molNaOH
(6)推测E和G反应得到K的过程中,反应物LiAlH4和H2O的作用是_______。
(7)由K合成托瑞米芬的过程:
![]()
托瑞米芬具有反式结构,其结构简式是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制备硝基苯的实验装置如图所示(夹持装置已略去)。下列说法不正确的是( )

A.水浴加热的优点为使反应物受热均匀、容易控制温度
B.仪器a的作用是冷凝回流,提高原料的利用率
C.浓硫酸、浓硝酸和苯混合时,应先向浓硫酸中缓缓加入浓硝酸,待冷却至室温后,再将所得混合物加入苯中
D.反应完全后,可用蒸馏的方法分离苯和硝基苯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设[aX+bY]为a个X微粒和b个Y微粒组成的一个微粒集合体,NA为阿伏加德罗常数的值。下列说法不正确的是
A.H2(g)+![]() O2(g)=H2O(l) ΔH=-286 kJ·mol1,则每1 mol [H2(g)+
O2(g)=H2O(l) ΔH=-286 kJ·mol1,则每1 mol [H2(g)+![]() O2(g)]生成1 mol [H2O(l)]放热286 kJ
O2(g)]生成1 mol [H2O(l)]放热286 kJ
B.Cr2O72-+ne+14H+=2Cr3++7H2O,则每生成1 mol Cr3+转移电子数为3NA
C.Al3++4OH=[Al(OH)4],说明1 mol Al(OH)3电离出H+数为NA
D.1 mol CO2与NaOH溶液完全反应,则n(CO32-)+n(HCO3-)+n(H2CO3)=1 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,某反应达到了化学平衡,其反应过程对应的能量变化如图。
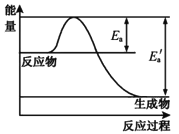
下列说法正确的是( )
A.Ea为逆反应活化能,Ea′为正反应活化能
B.温度升高,逆反应速率加快幅度大于正反应加快幅度,使平衡逆移
C.所有活化分子的平均能量高于或等于所有分子的平均能量
D.该反应为放热反应,ΔH=Ea′-Ea
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由三种元素组成的化合物A,按如下流程进行实验。气体B为纯净物,溶液C焰色反应为砖红色,气体E能使湿润的红色石蕊试纸变蓝。
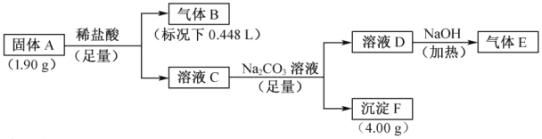
请回答:
(1)组成A的三种元素是________,A的化学式是________。
(2)固体A与足量稀盐酸反应的化学方程式是________。
(3)气体E与甲醛在一定条件可生成乌洛托品(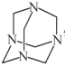 学名:六亚甲基四胺),该反应的化学方程式是________(乌洛托品可以用分子式表示)。
学名:六亚甲基四胺),该反应的化学方程式是________(乌洛托品可以用分子式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯气是一种重要的工业原料。工业上利用下列反应来检查氯气管道是否漏气:3Cl2+8NH3=N2+6NH4Cl,下列说法错误的是
A. 若有白烟产生则管道漏气 B. 该反应中NH4Cl是还原产物
C. 反应中NH3只显还原性 D. 生成1.4gN2时转移0.3mol电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硝酸铁具有较强的氧化性,易溶于水,乙醇等,微溶于浓硝酸。可用于金属表面化学抛光剂。
(1)制备硝酸铁
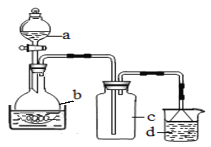
取100mL 8mol· L-1硝酸于a中,取 5.6g铁屑于b中,水浴保持反应温度不超过70℃。
①b中硝酸与铁屑混合后,铁屑溶解,溶液变黄色,液面上方有红棕色气体。写出b中发生反应的离子方程式:_______。
②若用实验制得的硝酸铁溶液,获取硝酸铁晶体,应进行的操作是:将溶液小心加热浓缩、_________、___________,用浓硝酸洗涤、干燥。
(2)探究硝酸铁的性质。用硝酸铁晶体配制0.1mol·L-1硝酸铁溶液,溶液呈黄色,进行实验如下:
实验一:硝酸铁溶液与银反应:
i.测0.1mol·L-1硝酸铁溶液pH约等于1.6 。
ii.将5mL 0.1mol·L-1硝酸铁溶液加到有银镜的试管中,约1min银镜完全溶解。使银镜溶解的反应原理有两个反应:
a. Fe3+使银镜溶解 b. NO3-使银镜溶解
①证明Fe3+使银镜溶解,应辅助进行的实验操作是_________。
②用5mL __________溶液,加到有银镜的试管中,约1.2min银镜完全溶解。证明NO3-使银镜溶解。
③为进一步研究溶解过程,用5mLpH约等于1.6的0.05mol·L-1硫酸铁溶液,加到有银镜的试管中,约10min银镜完全溶解。
实验二:硝酸铁溶液与二氧化硫反应,用如图所示装置进行实验:
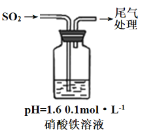
i.缓慢通入SO2,溶液液面上方出现红棕色气体,溶液仍呈黄色。
ii.继续持续通入SO2,溶液逐渐变为深棕色。
已知:Fe2++NO[Fe(NO)]2+(深棕色)
④步骤i反应开始时,以NO3-氧化SO2为主,理由是:_________。
⑤步骤ii后期反应的离子方程式是__________。
(3)由以上探究硝酸铁的性质实验得出的结论是__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com