
| A. | 由乙酸和乙醇生成乙酸乙酯的反应类型和由溴乙烷生成乙烯的反应类型相同 | |
| B. | 糖类、油脂和蛋白质均能发生水解反应 | |
| C. | 丙烯在一定条件下可与氯气发生取代反应生成3-氯丙烯 | |
| D. | 甲苯与氯气在光照下发生取代反应主要生成2,4二氯甲苯 |
分析 A.乙酸和乙醇发生取代反应生成乙酸乙酯,溴乙烷发生消去反应生成乙烯;
B.单糖不发生水解;
C.丙烯在光照条件下与氯气发生取代反应;
D.甲苯与氯气在光照下取代甲基的H原子.
解答 解:A.乙酸和乙醇发生取代反应生成乙酸乙酯,溴乙烷发生消去反应生成乙烯,反应类型不同,故A错误;
B.单糖为最简单的糖,不发生水解,如葡萄糖等,故B错误;
C.丙烯在光照条件下与氯气发生取代反应,可生成3-氯丙烯,故C正确;
D.甲苯与氯气在光照下取代甲基的H原子,如生成2,4二氯甲苯,应在催化条件下,故D错误.
故选C.
点评 本题考查有机物的结构与性质,为高频考点,把握官能团与性质的关系为解答的关键,侧重分析与应用能力的考查,选项D为解答的难点,题目难度中等.


 尖子生新课堂课时作业系列答案
尖子生新课堂课时作业系列答案 英才计划同步课时高效训练系列答案
英才计划同步课时高效训练系列答案科目:高中化学 来源: 题型:选择题
| A. | 在水蒸气、液态水和冰中,水分子都在不停地运动 | |
| B. | NaCl溶于水后,因为共价键被破坏,从而形成了Na+和Cl- | |
| C. | 在N2、CO2和SiO2物质中,都存在共价键,它们都是由分子构成 | |
| D. | H2S分子中,所有原子的最外层都达到了8电子的稳定结构 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
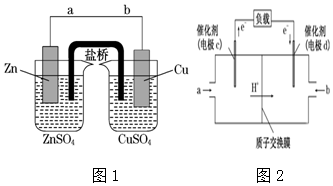
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
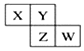 如图所示X、Y、Z、W均为短周期元素,它们在周期表中的相对位置如图所示.若X原子的最外层电子数是内层电子数的2倍,下列说法中正确的是( )
如图所示X、Y、Z、W均为短周期元素,它们在周期表中的相对位置如图所示.若X原子的最外层电子数是内层电子数的2倍,下列说法中正确的是( )| A. | X、Y对应的氧化物都是酸性氧化物 | |
| B. | X的氧化物不能与Mg发生化学反应 | |
| C. | Z比Y更容易与氢气化合 | |
| D. | W与X形成的化合物中化学键类型为共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在放电时,两极质量均增加 | |
| B. | 在充电时,电池中硫酸的浓度不断变小 | |
| C. | 在放电时,负极发生的反应是 Pb+2e-+SO42-=PbSO4 | |
| D. | 在放电时,正极发生的反应是 PbSO4+2e-=Pb+SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
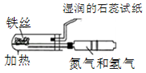 | 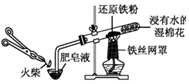 |
| A.模拟工业制氨气并检验产物 | B.一段时间后,试管中固体变为红棕色 |
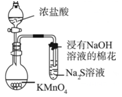 | 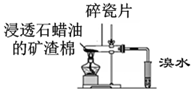 |
| C.可用所示装置比较KMnO4、Cl2、S的氧化性强弱 | D.若溴水褪色则证明石蜡油分解产生乙烯 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 短周期元素W、X、Y、Z的原子序数依次增加.甲、乙、丙、丁是由这些元素组成的二元化合物,乙为无色气体,丙为无色液体,丁为淡黄色固体.戊是元素Y的单质,是空气的主要成分,乙遇空气变红棕色,丁与丙反应有戊生成;己是元素Z的单质.上述物质的转化关系如图所示.下列说法错误的是( )
短周期元素W、X、Y、Z的原子序数依次增加.甲、乙、丙、丁是由这些元素组成的二元化合物,乙为无色气体,丙为无色液体,丁为淡黄色固体.戊是元素Y的单质,是空气的主要成分,乙遇空气变红棕色,丁与丙反应有戊生成;己是元素Z的单质.上述物质的转化关系如图所示.下列说法错误的是( )| A. | 原子半径Z>X>Y>W | B. | 丙的热稳定性不如甲 | ||
| C. | X的最高价氧化物的水化物为强酸 | D. | Z的最高价氧化物的水化物为强碱 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 检验NaCl中含有Na2CO3,加水溶解 | |
| B. | 鉴别NaCl和Na2CO3溶液,加适量盐酸 | |
| C. | 除去CaO中的CaCO3,加足量稀盐酸 | |
| D. | 除去CO2中少量的CO,通入O2,点燃 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
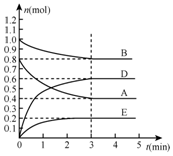 在某个容积为2L的密闭容器内,在T℃时按下图1所示发生反应:mA(g)+nB(g)?pC(g)+qE(s),△H<0(m、n、p、q为最简比例的整数).
在某个容积为2L的密闭容器内,在T℃时按下图1所示发生反应:mA(g)+nB(g)?pC(g)+qE(s),△H<0(m、n、p、q为最简比例的整数).查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com