
分析 (1)N-H键比P-H键短,则N-H键的键能大,化合物中电负性大显负价;
(2)PH3分子与氨气分子结构相似,N2H4分子中,N形成2个N-H和1个N-N,且含孤对电子,根据价层电子对互斥理论确定分子的空间构型和原子的杂化方式;
(3)①根据共价化合物电子式的书写规则书写;
②同种非金属元素之间易形成非极性共价键,不同非金属元素之间易形成极性共价键;
③电负性越大的元素在化合物中显负价态,电负性小的元素在化合物中显正价态,且正负化合价的代数和为0;
④计算S原子的价层电子对数、孤对电子对数.
解答 解:(1)氮原子原子半径小于磷原子原子半径,原子半径越大的,键长越长,键长越小的键能越大,所以键长:NH3小于PH3、键能:NH3 大于PH3,P的电负性小于H,所以H显负价,H得一个电子达到稳定结构,所以H显-1价;
故答案为:小于;大于;-1价;
(2)PH3分子中价层电子对=3+1=4,含有一个孤电子对,所以其空间构型是三角锥型,VSEPR模型是四面体;N2H4分子中氮原子的加成电子对=3+1=4,含有一个孤电子对,N原子轨道的杂化类型是sp3;
故答案为:四面体;sp3;
(3)①二氯化硫的电子式为 ,结构式为Cl-S-S-Cl,故答案为:Cl-S-S-Cl;
,结构式为Cl-S-S-Cl,故答案为:Cl-S-S-Cl;
②S-S键是非极性共价键,S-Cl是极性共价键,故答案为:非极性共价键和极性共价键;
③氯元素的电负性大于硫元素,所以硫元素显正价,硫原子和氯原子间共用一个电子对,所以硫显+1价;
故答案为:+1;
④S原子的孤对电子对数=$\frac{6-2×2}{2}$=1,价层电子对数=2+1=3,故空间构型为V形,S原子产生sp2杂化,VSEPR构型为平面三角形,故答案为:V形;平面三角形.
点评 本题考查杂化理论及分子构型判断,为高频考点,把握原子结构与性质为解答的关键,侧重分析与应用能力的考查,题目难度中等.


科目:高中化学 来源: 题型:填空题
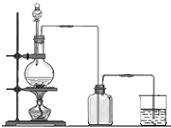 实验室用MnO2和浓盐酸反应制取Cl2,气体发生和收集装置如图.请回答:
实验室用MnO2和浓盐酸反应制取Cl2,气体发生和收集装置如图.请回答:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 小苏打是面包发酵粉的主要成分之一 | |
| B. | 碳酸钠可作胃酸的中和剂 | |
| C. | “血液透析”利用了胶体的性质 | |
| D. | 利用明矾溶液的酸性清除铜镜表面的铜锈 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
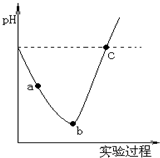 在常温下,取一定量的蒸馏水,然后将Cl2缓慢通入水中至饱和,再向所得饱和氯水中滴加0.1mol/L的NaOH溶液.整个实验进程中溶液的pH变化曲线如图所示,下列叙述正确的是( )
在常温下,取一定量的蒸馏水,然后将Cl2缓慢通入水中至饱和,再向所得饱和氯水中滴加0.1mol/L的NaOH溶液.整个实验进程中溶液的pH变化曲线如图所示,下列叙述正确的是( )| A. | 实验进程中可用pH试纸测定溶液的pH | |
| B. | 向a点所示溶液中能入SO2,溶液的酸性和漂白性均增强 | |
| C. | 由a点到b点的过程中,溶液中c(H+)/c(ClO-)减小 | |
| D. | c点所示的溶液中,c(Na+)=c(ClO-)+c(Cl-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1000mL,106g | B. | 1000mL,286g | C. | 950mL,100.7g | D. | 950mL,271.7g |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
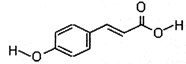
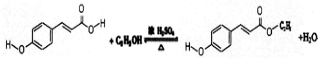 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
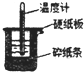 50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com