
已知下列过程都能自发进行,其中不能用“焓判据”解释的是( )
|
| A. | 2Na(s)+Cl2(g)═2NaCl(s)△H<0 |
|
| B. | C3H8(g)+5O2(g)═3CO2(g)+4H2O(l)△H<0 |
|
| C. | 2NH4Cl(s)+Ca(OH)2(s)═2NH3(g)+CaCl2(s)+2H2O(l)△H>0 |
|
| D. | 2Mg(s)+O2(g)═2MgO△H<0 |
考点:
焓变和熵变.
专题:
化学反应中的能量变化.
分析:
反应能否自发进行取决于焓变和熵变的综合判据,当△G=△H﹣T△S<0时,反应可自发进行,熵增有利于反应自发进行,放热有利于反应的自发进行.
解答:
解:A.该反应是一个熵减小的反应,△ S<0,要使△H﹣T△S<0,则△H必须小于0,所以反应能否自发进行主要取决于焓判据,故A正确;
B.该反应是一个熵减小的反应,△S<0,要使△H﹣T△S<0,则△H必须小于0,所以反应能否自发进行主要取决于焓判据,故B正确;
C.该反应△H>0,是吸热反应,要使△H﹣T△S<0,则△S必须大于0,所以反应能否自发进行主要取决于熵判据,故C错误;
D.该反应是一个熵减小的反应,△S<0,要使△H﹣T△S<0,则△H必须小于0,所以反应能否自发进行主要取决于焓判据,故D正确;
故选C.
点评:
本题考查了反应自发进行的判据,注意熵变和焓变都是与反应能否自发进行有关,但都不是唯一因素,反应能自发进行取决于△H﹣T△S<0.


科目:高中化学 来源: 题型:
铁和铜的混合物中加入不足量的硝酸,反应后剩余金属m1g;再向其中加入一定量该硝酸,充分振荡后,剩余金属m2 g,则m1.m2之间的关系正确的是 ( )
A.m1一定大于m2 B.m1可能等于m2 C.m1一定等于m2 D.m1不可能大于m2
查看答案和解析>>
科目:高中化学 来源: 题型:
某容器中发生一个化学反应,反应过程中存在H2O、ClO-、 NH3、N2、Cl-五种物质,在反应过程中测得ClO-和N2的物质的量随时间变化的曲线如图所示。下列有关判断中正确的是 ( )
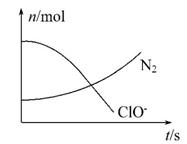
A.还原剂是NH3,氧化产物是Cl-
B.配平后氧化剂与还原剂的化学计量数之比为3∶2
C.该反应中氧化反应过程是ClO-→Cl-
D.标准状况下,若生成2.24 L N2,则转移电子为0.5 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
下列热化学方程式书写正确的是( )
|
| A. | 2SO2+O2=2SO3 △H=﹣196.6kJ•mol﹣1 |
|
| B. | H2(g)+ |
|
| C. | 2H2(g)+O2(g)=2H2O(l)△H=﹣571.6kJ |
|
| D. | C(s)+O2(g)=CO2(g)△H=+393.5kJ•mol﹣1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
在1 000K时,已知反应Ni(s)+H2O(g)⇌NiO(s)+H2(g)的平衡常数K=0.0059.当水蒸气和氢气的物质的量浓度相等时,此反应( )
|
| A. | 未达平衡状态,反应逆向进行 |
|
| B. | 未达平衡状态,反应正向进行 |
|
| C. | 已达平衡状态 |
|
| D. | 无法确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:
在一定条件下,二氧化硫和氧气发生如下反应:2SO2(g)+O2(g)⇌2SO3(g)△H<0
(1)写出该反应的化学平衡常数表达式K= .
(2)降低温度,该反应K值 ,二氧化硫转化率 (以上均填“增大”、“减小”或“不变”).
查看答案和解析>>
科目:高中化学 来源: 题型:
我国科学家在世界上第一次为一种名为“钴酞菁”的分子(直径为1.3nm)恢复了磁性.“钴酞菁”分子的结构和性质与人体内的血红素及植物体内的叶绿素非常相似.下列说法中不正确的是( )
|
| A. | “钴酞菁”分子分散在水中所形成的分散系不具有丁达尔效应 |
|
| B. | “钴酞菁”分子能透过滤纸 |
|
| C. | 此项工作可以用来改变分子的某些物理性质 |
|
| D. | 此项工作可广泛应用于光电器件、生物技术等方面 |
查看答案和解析>>
科目:高中化学 来源: 题型:
纯碱是工业生产和日常生活中的重要物质.某兴趣小组为测定某工业纯碱(假设仅含碳酸氢钠杂质)中碳酸钠的质量分数,设计了下列三种实验方案进行探究.请填空:
方案一:纯碱样品 测定剩余固体质量
测定剩余固体质量
(1)分别称取干燥坩埚和纯碱样品的质量,将纯碱样品放入坩埚中充分加热(如右图).坩埚中发生反应的化学方程式为: .
(2)将坩埚置于干燥器中冷却后称量.实验时需要重复“加热、冷却、称量”操作多次,其目的是: .
方案二:纯碱样品溶液 测定沉淀质量
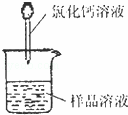
测定沉淀质量
(1)称取m1g样品,置于小烧杯中,加水溶解.向小烧杯中滴加足量氯化钙溶液(如图).将反应混和物过滤后的下一步操作是: .
(2)沉淀经干燥后称量为m2g,则该样品中碳酸钠的质量分数为: %.
(3)如果用氢氧化钙溶液代替氯化钙溶液作沉淀剂,在其他操作正确的情况下,测得样品中的碳酸钠质量分数将比实际 (填“偏高”、“偏低”或“不变”).
方案三:纯碱样品 测定生成二氧化碳的质量
测定生成二氧化碳的质量
(1)本实验采用vk图装置,C中盛放的物质是 .
(2)反应前后都要通入N2,反应后通入N2的目的是: 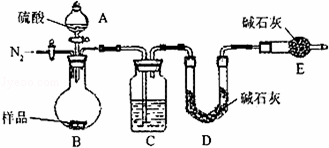

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com