
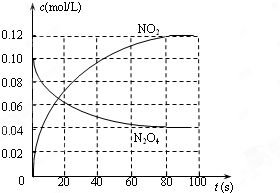
在100℃时,将0.200 mol的四氧化二氮气体充入2L抽空的密闭容器中,每隔一定时间对该容器内的物质进行分析,得到如下表格:
| 时间 | 0 | 20 | 40 | 60 | 80 | 100 |
| c(N2O4) | 0.100 | c1 | 0.050 | c3 | a | b |
| c(NO2) | 0.000 | 0.060 | c2 | 0.120 | 0.120 | 0.120 |
(1)N2O4 2NO2, 60% (2)0.070 ,0.0015 (3)0.2 (每空2分)
2NO2, 60% (2)0.070 ,0.0015 (3)0.2 (每空2分)
解析试题分析:(1)根据表中数据可知,N2O4是反应物,NO2是生成物,所以该反应的化学方程式为N2O4 2NO2。平衡时NO2的浓度是0.120mol/L,则根据方程式可知消耗N2O4的浓度是0.120mol/L÷2=0.060mol/L,因此NO2的转化率是
2NO2。平衡时NO2的浓度是0.120mol/L,则根据方程式可知消耗N2O4的浓度是0.120mol/L÷2=0.060mol/L,因此NO2的转化率是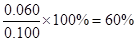 。
。
(2)(2)20s时NO2的浓度是0.060mol/L,则消耗N2O4的浓度是0.030mol/L,所以四氧化二氮的浓度c1=0.100mol/L-0.030mol/L=0.070mol/L。则在0~20s时间段内,四氧化二氮的平均反应速率为0.030mol/L÷20s=0.0015_mol?L-1?s-1。
(3)由于N2O4的最初浓度是0.100mol/L,完全转化为NO2时,NO2的浓度应该是0.200mol/L,所以若在相同情况下最初向容器中充入的是二氧化氮气体,要达到上述同样的平衡状态,二氧化氮的初始浓度为0.200mol/L。
考点:考查可逆反应的有关计算和等效平衡的有关应用
点评:该题是中等难度的试题,试题基础性强,难易适中,侧重对学生基础知识的巩固与训练,有助于培养学生的应试能力,提高学生的学习效率。该题的难点是等效平衡的判断和应用,学生需要明确的是所谓等效平衡是指外界条件相同时,同一可逆反应只要起始浓度相当,无论经过何种途径,都可以达到相同的平衡状态。等效平衡的判断及处理一般步骤是:进行等效转化——边倒法,即按照反应方程式的计量数之比转化到同一边的量,与题干所给起始投料情况比较即可。


 举一反三同步巧讲精练系列答案
举一反三同步巧讲精练系列答案 口算与应用题卡系列答案
口算与应用题卡系列答案 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案科目:高中化学 来源: 题型:
| 时间(s) | 0 | 20 | 40 | 60 | 80 |
| n(NO2)/mol | 0.40 | n1 | 0.26 | n3 | n4 |
| n(N2O4)/mol | 0.00 | 0.05 | n2 | 0.08 | 0.08 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 在100℃时,将0.40mol二氧化氮气体充入2L抽空的密闭容器中,每隔一定时间就对该容器内的物质进行分析,得到如下表数据:
在100℃时,将0.40mol二氧化氮气体充入2L抽空的密闭容器中,每隔一定时间就对该容器内的物质进行分析,得到如下表数据:| 时间(s) | 0 | 20 | 40 | 60 | 80 |
| n(NO2)/mol | 0.40 | n1 | 0.26 | n3 | n4 |
| n(N2O4)/mol | 0.00 | 0.05 | n2 | 0.08 | 0.08 |

查看答案和解析>>
科目:高中化学 来源: 题型:
在100℃时,将0.40molNO2气体充入2L密闭容器中,每隔一段时间对该容器的物质进行测量,得到的数据如下表:
|
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
 非金属元素氮有多种氧化物,如NO、NO2、N2O4等.
非金属元素氮有多种氧化物,如NO、NO2、N2O4等.| 时间(s) | 0 | 20 | 40 | 60 | 80 |
| n(NO2)/mol | 0.40 | n1 | 0.26 | n3 | n4 |
| n(N2O4)/mol | 0.00 | 0.05 | n2 | 0.08 | 0.08 |
查看答案和解析>>
科目:高中化学 来源: 题型:
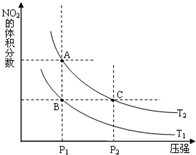 氮可形成多种氧化物,如NO、NO2、N2O4等,NO2和N2O4可以相互转化.
氮可形成多种氧化物,如NO、NO2、N2O4等,NO2和N2O4可以相互转化.| 时间(s) | 0 | 20 | 40 | 60 | 80 |
| n(NO2)/mol | 0.40 | n1 | 0.26 | n3 | n4 |
| n(N2O4)/mol | 0.00 | 0.05 | n2 | 0.08 | 0.08 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com