
| A. | K+、Ca2+、HCO3-、Cl- | B. | Na+、K+、Cl-、SO42- | ||
| C. | NH4+、K+、Cl-、SO32- | D. | K+、Cl-、NO3-、SO42- |
分析 某溶液与Al反应能放出H2,为强碱或酸溶液,根据离子之间不能结合生成沉淀、气体、水等,不能发生氧化还原反应等,则离子大量共存,以此来解答.
解答 解:某溶液与Al反应能放出H2,为强碱或酸溶液,
A.HCO3-与酸、碱均反应,不能大量共存,故A不选;
B.酸、碱溶液中该组离子之间不反应,可大量共存,故B选;
C.酸溶液中不能大量存在SO32-,碱溶液中不能大量存在NH4+,故C不选;
D.酸性溶液中Al、H+、NO3-发生氧化还原反应,不能大量共存,故D不选;
故选B.
点评 本题考查离子共存,为高频考点,把握习题中信息及常见离子之间的反应为解答的关键,侧重复分解反应、氧化还原反应的离子共存的考查,题目难度不大.


 优学名师名题系列答案
优学名师名题系列答案科目:高中化学 来源: 题型:选择题
| A. | 阴、阳离子之间通过相互吸引作用形成的化学键叫离子键 | |
| B. | 根据电离方程式HCl=H++Cl-,可判断HC1分子里存在离子键 | |
| C. | 化学键的断裂和形成是化学反应能量变化的主要原因 | |
| D. | 离子化合物一定由金属元素和非金属元素组成 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH4的沸点比SiH4低,而CH4比SiH4热稳定性强 | |
| B. | 有机物大多难溶于水,而乙醇和乙酸可与水互溶 | |
| C. | H2O2和H2S的相对分子相近,而H2O2的沸点远高于H2S | |
| D. | 采用加压液化的方法从氨合成塔里分离出NH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
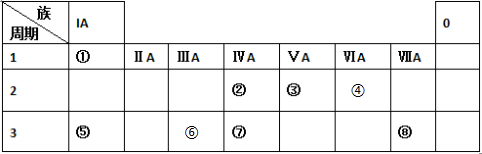
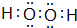 .
.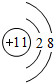 .
.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 碳酸钠(固体) | B. | 水 | C. | 硫酸钾溶液 | D. | 浓硝酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 40s | B. | 15s | C. | 30s | D. | 20s |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯通入酸性高锰酸钾溶液 | |
| B. | 氯气用足量氢氧化钠溶液吸收 | |
| C. | 铁粉投入硫酸铜溶液 | |
| D. | 往淀粉和碘化钾的混合溶液中滴加适量的氯化铁溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 .乙烯酮在一定条件下可与下列试剂加成,其产物不正确的是( )
.乙烯酮在一定条件下可与下列试剂加成,其产物不正确的是( )| A. | 与CH3OH加成生成CH3CH2COOH | B. | 与H2O加成生成CH3COOH | ||
| C. | 与CH3COOH加成生成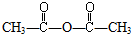 | D. | 与HCl加成生成CH3COCl |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
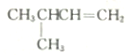 3-甲基-1-丁烯.
3-甲基-1-丁烯.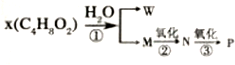
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com