铜、铁、铝是重要的金属材料,铜、铁、铝及其化合物有非常重要的用途.
(1)铁元素与氯元素可形成FeCl
2和FeCl
3两种化合物,下列说法正确的是
(填序号).
①保存FeCl
2溶液时,需向溶液中加入少量Fe
②FeCl
2只能通过置换反应生成,FeCl
3只能通过化合反应生成
③铜片、碳棒和FeCl
3溶液组成原电池,电子由铜片沿导线流向碳棒
④制备AlCl
3、FeCl
3、CuCl
2均能采用将溶液直接蒸干的方法
⑤含a mol AlCl
3的溶液和含1.5a mol NaOH的溶液,无论正滴和反滴,生成的
Al(OH)
3的质量相等
(2)高铁酸钾(K
2FeO
4)是一种高效多功能水处理剂.K
2FeO
4可以铁为电极,通过电解浓的KOH溶液来制取,写出电解法制取K
2FeO
4的阳极反应式:
.
(3)黄铁矿(FeS
2)是生产硫酸和冶炼钢铁的重要原料.其中一个反应为3FeS
2+8O
2═6SO
2+Fe
3O
4,有3mol FeS
2参加反应,转移
mol电子.
(4)氯化铁溶液常用作印刷电路铜板腐蚀剂,反应的离子方程式为
;
从腐蚀废液回收得到金属铜,还需要的试剂是
.
(5)工业上常用铝土矿(含SiO
2等杂质)生产铝.从Na
2SiO
3和NaAlO
2混合溶液中制得Al(OH)
3,需要从下列试剂中选择两种,选用的试剂组合最好是
.
a.NaOH溶液 b.氨水 c.CO
2 d.盐酸
(6)已知25℃时K
sp[Mg(OH)
2]=5.6×10
-12,K
sp[Cu(OH)
2]=2.2×10
-20,K
sp[Fe(OH)
3]=4.0×10
-38,K
sp[Al(OH)
3]=1.1×10
-33①在25℃下,向浓度均为0.1mol?L
-1的AlCl
3和CuCl
2混合溶液中逐滴加入氨水,先生成
沉淀(填化学式).
②用MgCl
2、AlCl
3的混合溶液(A) 与过量氨水(B) 反应,为使Mg
2+、Al
3+同时生成沉淀,应先向沉淀反应器中加入
(填“A”或“B”),再滴加另一反应物.
③溶液中某离子物质的量浓度低于1.0×10
-5 mol?L
-1时,可认为已沉淀完全.现向一定浓度的AlCl
3和FeCl
3的混合溶液中逐滴加入氨水,当Fe
3+完全沉淀时,测定c(Al
3+)=0.2 mol?L
-1.此时所得沉淀中
(填“还含有”或“不含有”)Al(OH)
3.



 一本好题口算题卡系列答案
一本好题口算题卡系列答案
 +CH2=CH2
+CH2=CH2


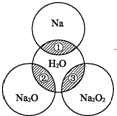 如图所示,两圆圈相交的阴影部分表示圆圈内的物质相互发生的反应.已知钠及其氧化物的物质的量均为0.1mol,水的质量为100g.下列说法正确的是( )
如图所示,两圆圈相交的阴影部分表示圆圈内的物质相互发生的反应.已知钠及其氧化物的物质的量均为0.1mol,水的质量为100g.下列说法正确的是( )